পরিমাণগত রসায়ন কাকে বলে?
উত্তরঃ রাসায়নিক বিক্রিয়ার বিক্রিয়ক ও উৎপাদের মোলভিত্তিক গণনাকে পরিমাণগত রসায়ন বা Stoichiometric Chemistry বলে।
মিথাইল অরেঞ্জ এসিড মাধ্যমে কি বর্ণ দেয়?
উত্তরঃ মিথাইল অরেঞ্জ এসিড মাধ্যমে লাল বর্ণ দেয়।
অম্লত্ব কী?
উত্তর : ক্ষারক কর্তৃক এসিডকে প্রশমিত করার ক্ষমতাই ঐ ক্ষারকের অম্লত্ব।
সেমিমোলার দ্রবণের ঘনমাত্রা কত?
উত্তর : সেমিমোলার দ্রবণের ঘনমাত্রা 0.5M।
দ্রবণের ঘনমাত্রা প্রকাশের শতকরা হারকে কয়ভাগে প্রকাশ করা যায়?
উত্তর : দ্রবণের ঘনমাত্রা প্রকাশের শতকরা হারকে ৩ ভাগে প্রকাশ করা যায়।
মোলার এবজরবিটি কাকে বলে?
উত্তর : মোল এককে শোষিত বস্তুর ওজনকে মোলার এবজরবিটি বলে।
অণু কর্তৃক শোষিত আলো কোন নীতির সাহায্যে ব্যাখ্যা করা যায়?
উত্তর : বিয়ার নীতি ও ল্যাম্বার্ট নীতি।
জারক কাকে বলে?
উত্তরঃ রাসায়নিক বিক্রিয়ায় যে পরমাণু বা মূলক বা যৌগ অন্য পরমাণু, মূলক বা যৌগকে জারিত করে তাকে জারক বলে। যেমন, O2, HNO₃, KMnO₄, K2Cr2O7, HCl, CO2, K3[Fe(CN)6], H2O2 ইত্যাদি।
বিজারক কাকে বলে?
উত্তরঃ রাসায়নিক বিক্রিয়ায় যে পরমাণু, মূলক বা আয়ন ইলেকট্রন ত্যাগ করে তাদেরকে বিজারক বলে। বিজারকসমূহ অন্য পরমাণু বা মূলককে বিজারিত করে। যেমন, NaBH4, H2O2, H₂S, Fe2+, FeCl2, Na2S2O3।
প্রাইমারি স্ট্যান্ডার্ড পদার্থ কি?
উত্তরঃ প্রাইমারি স্ট্যান্ডার্ড পদার্থ হচ্ছে এমন এক ধরনের পদার্থ যেগুলো কঠিন রাসায়নিক পদার্থ হিসেবে বিশুদ্ধ অবস্থায় পাওয়া যায়। এছাড়া এ সব পদার্থ বায়ুর সংস্পর্শে অপরিবর্তিত থাকে অর্থাৎ বায়ুতে থাকা CO2, O2 ও জলীয় বাষ্প দ্বারা আক্রান্ত হয় না, রাসায়নিক নিক্তিতে সঠিকভাবে ভর মেপে প্রমাণ দ্রবণ প্রস্তুত করা যায় এবং প্রস্তুতকৃত প্রমাণ দ্রবণের ঘনমাত্রা অনেকদিন পর্যন্ত অপরিবর্তিত থাকে। যেমন- অনার্দ্র সোডিয়াম কার্বনেট (Na2CO3), আর্দ্র অক্সালিক এসিড (H2C2O4.2H2O), K2Cr2O7, Na2C2O4.2H2O।
প্রাইমারি স্ট্যান্ডার্ড পদার্থের বৈশিষ্ট্য কী কী?
উত্তরঃ প্রাইমারি স্ট্যান্ডার্ড পদার্থের বৈশিষ্ট্য নিম্নরূপঃ
১. প্রাইমারি স্ট্যান্ডার্ড পদার্থগুলোকে বিশুদ্ধ অবস্থায় পাওয়া যায়;
২. এগুলো বায়ুতে থাকা CO2, O2 ও জলীয় বাষ্প দ্বারা আক্রান্ত হয় না;
৩. রাসায়নিক নিক্তিতে সঠিকভাবে ভর মেপে প্রমাণ দ্রবণ প্রস্তুত করা যায়;
৪. পানিত্যাগী, পানিগ্রাহী ও পানিগ্রাসী নয়।
সেকেন্ডারী স্ট্যান্ডার্ড পদার্থ কাকে বলে?
উত্তরঃ যেসব পদার্থ প্রকৃতিতে বিশুদ্ধ ও শুষ্ক অবস্থায় পাওয়া যায় না, বাতাসের অক্সিজেন, কার্বন ডাই-অক্সাইড, জলীয়বাষ্প ইত্যাদির সাথে বিক্রিয়া করে, রাসায়নিক নীক্তিতে সঠিকভাবে ওজন করা যায় না এবং যাদের দ্বারা তৈরিকৃত দ্রবণের ঘনমাত্রা অল্পসময়ে পরিবর্তিত হয় তাদেরকে সেকেন্ডারী স্ট্যান্ডার্ড পদার্থ বলে। যেমনঃ সালফিউরিক অ্যাসিড (H₂SO₄), পটাশিয়াম পারম্যাঙ্গানেট (KMnO₄), হাইড্রোক্লোরিক এসিড (HCl), সোডিয়াম হাইড্রোক্সাইড (NaOH), পটাশিয়াম হাইড্রোক্সাইড (KOH) ইত্যাদি।
জারক ও বিজারকের মধ্যে পার্থক্য কি?
উত্তরঃ জারক ও বিজারকের মধ্যে দুটি পার্থক্য তুলে ধরা হলো–
Cr2O72- + 14H+ + 6Fe2+ → 2Cr3+ + 6Fe3+ + 7H2O
50 mL 0.1 M Na2CO3 দ্রবণ তৈরি করে কনিক্যাল ফ্লাস্কে নেওয়া হলো। উক্ত দ্রবণকে 0.5 M HCI দ্বারা টাইট্রেশন করা হলো।
শাকিল 2.5% NaOH এর 100mL কে 0.25M CH3COOH দ্বারা টাইট্রেশন করলো।
মোলার দ্রবণ বা মোলারিটি বলতে কী বুঝ?
নির্দিষ্ট তাপমাত্রায় 1 লিটার দ্রবণে 1 মোল দ্রব দ্রবীভূত থাকলে, তাকে ঐ তাপমাত্রায় ঐ দ্রবের মোলার দ্রবণ বলে।
নির্দিষ্ট তাপমাত্রায় প্রতি লিটার দ্রবণে দ্রবীভূত দ্রবের মোল সংখ্যাকে ঐ দ্রবণের মোলারিটি বলে। একে M দ্বারা প্রকাশ করা হয়। এর একক হল molL−1
মোলারিটি, S = লিটার দ্রবণের আয়তন মোল এককে দ্রবের ভর
S=Vn=M×VWn=MW(এখানে V লিটার এককে)
বা, S=M×VW×1000 [ এক্ষেত্রে V এর আয়তন mL এ বসানো হয় ]
ডেসিমোলার, সেমিমোলার এবং সেন্টিমোলার দ্রবণ বলতে কি বুঝ?
নির্দিষ্ট তাপমাত্রায় –
1L দ্রবণে 1 mol বা 98g H2SO4 থাকলে তাকে 1M বা মোলার দ্রবণ বলে।
1L দ্রবণে 0.5 mol বা 49g H2SO4 থাকলে তাকে 0.5M বা সেমিমোলার দ্রবণ বলে।
1L দ্রবণে 0.1 mol বা 9.8g H2SO4 থাকলে তাকে 0.1M বা ডেসিমোলার দ্রবণ বলে।
1L দ্রবণে 0.01 mol বা 0.98g H2SO4 থাকলে তাকে 0.01M বা সেন্টিমোলার দ্রবণ বলে।
প্রমাণ দ্রবণ বলতে কী বুঝ?
নির্দিষ্ট তাপমাত্রায় নির্দিষ্ট আয়তনের দ্রবণে দ্রবীভূত দ্রবের পরিমাণ জানা থাকলে তাকে ঐ দ্রবের প্রমাণ দ্রবণ বলে। যেমন– 0.1M Na2CO3 দ্রবণ একটি প্রমাণ দ্রবণ। কারণ নির্দিষ্ট তাপমাত্রায় দ্রবণে কী পরিমাণ দ্রব আছে তা জানা যায়। যেমন – নির্দিষ্ট তাপমাত্রায় প্রতি লিটার দ্রবণে 0.1mol বা 10.6 gm Na2CO3 দ্রবীভূত আছে।
মোলার দ্রবনে নির্দিষ্ট তাপমাত্রায় 1L দ্রবণে 1mol Na2CO3 দ্রব দ্রবীভূত আছে। যেহেতু নির্দিষ্ট আয়তনে দ্রবীভূত দ্রবের পরিমাণ জানা আছে, তাই এটি একটি প্রমাণ দ্রবণ হবে। এর মোলার দ্রবণ অর্থাৎ 1L দ্রবণে 1mol বা 106 gm Na2CO3 দ্রবীভুত আছে।
প্রতি kg দ্রাবকে 1mol পরিমাণ দ্রব দ্রবীভূত থাকলে দ্রবণটিকে ঐ দ্রবের মোলাল দ্রবণ বলে। তাছাড়া প্রতি kg দ্রাবকে দ্রবীভূত দ্রবের মোল সংখ্যাকে ঐ দ্রবণের মোলালিটি বলে। একে m দ্বারা প্রকাশ করা হয়।
এর একক হল molkg−1
m=kg এককে দ্রাবকের পরিমাণ মোল এককে দ্রবের পরিমাণ
মোলারিটি হল দ্রবের ভর ও দ্রবণের আয়তন সম্পর্কিত রাশি। তাপমাত্রা পরিবর্তনের ফলে দ্রবণের আয়তন পরিবর্তিত হয়, তাই আয়তন ভিত্তিক দ্রবণের ঘনমাত্রা মোলারিটি পরিবর্তিত হয়। কিন্তু তাপমাত্রা বৃদ্ধির সাথে বা তাপমাত্রা পরিবর্তনের সাথে বস্তুর ভরের কোন পরিবর্তন হয় না। তাই দ্রাবক ও দ্রব উভয়ে গ্রাম এককে প্রকাশিত দ্রবণের ঘনমাত্রা মোলালিটির পরিবর্তন ঘটে না। অর্থাৎ তাপমাত্রা পরিবর্তনের ফলে মোলারিটির পরিবর্তন ঘটে। কিন্তু মোলালিটির কোন পরিবর্তন ঘটে না। তাই মোলারিটির চেয়ে মোলালিটির ব্যবহার সুবিধাজনক বেশি।
যে সকল পদার্থ প্রকৃতিতে বিশুদ্ধ অবস্থায় পাওয়া যায়, যারা বস্তুর উপাদান O2 ও CO2 এর সাথে কোন বিক্রিয়া করে না, তারা পরিবাহী বা পানিগ্রাসী নয়, যারা রাসায়নিক নিক্তির উপাদানের সাথে বিক্রিয়া করে না বলে সঠিকভাবে ওজন করে সঠিক ঘনমাত্রায় দ্রবণ তৈরি করা যায় এবং যাদের দ্বারা প্রস্তুতকৃত দ্রবণের ঘনমাত্রা দীর্ঘদিন ধরে অপরিবর্তিত থাকে তাদেরকে প্রাইমারী স্ট্যান্ডার্ড পদার্থ বলে। যেমন– অনার্দ্র Na2CO3, K2Cr2O7, অক্সালিক এসিড (H2C2O4.2H2O),Na2C2O4,2H2O ইত্যাদি।
যে সকল পদার্থ প্রকৃতিতে বিশুদ্ধ অবস্থায় পাওয়া যায় না। যারা বায়ুর উপাদানের সাথে বিক্রিয়া করে। যারা পানিগ্রাহী বা পানিগ্রাসী, যার রাসায়নিক নিক্তির উপাদানের সাথে বিক্রিয়া করে বলে সঠিকভাবে ওজন পরিমাপ করা যায় না যাদের দ্বারা প্রস্তুতকৃত দ্রবণের ঘনমাত্রা কিছুসময় পর পরিবর্তন হয়ে যায় তাদেরকে সেকেন্ডারী স্ট্যান্ডার্ড পদার্থ বলে।
HCl,H2SO4,NaOH,KMnO4,Na2 S2O3.5H2O
গাঢ় H2SO4 এসিড সেকেন্ডারী স্ট্যান্ডার্ড পদার্থ কেন?
এটি একটি পানিগ্রাহী তরল পদার্থ, একটি ক্ষয়কারক এবং রাসায়নিক নিক্তির সংস্পর্শে আসলে এটি নিক্তির ক্ষয় করে। এর ফলে গাঢ় H2SO4 কে রাসায়নিক নিক্তিতে সঠিকভাবে পরিমাপ করা যায় না। তাই H2SO4একটি সেকেন্ডারী স্ট্যান্ডার্ড পদার্থ।
এটি বিশুদ্ধ অবস্থায় প্রকৃতিতে পাওয়া যায় না, এর দ্বারা প্রস্তুতকৃত দ্রবণ কিছু সময় রেখে দিলে দ্রবণের ঘনমাত্রা ধীরে ধীরে হ্রাস পায়। কারণ KMnO4 বিযোজিত হয়ে MnO2 এ পরিণত হয়। তাছাড়া সূর্যালোকের সংস্পর্শে KMnO4 পানিকে জারিত করে O2 এ পরিণত করে। তাই এটি একটি সেকেন্ডারী স্ট্যান্ডার্ড পদার্থ।
এটি একটি পানিগ্রাহী পদার্থ এবং ক্ষয়কারক বলে সঠিকভাবে এর ওজন পরিমাপ করা যায় না। তাছাড়া কাচপাত্রে রাখা হলে এটি কাচের উপাদান। সিলিকার সাথে বিক্রিয়া করে ঘনমাত্রা পরিবর্তন করে বা ঘনমাত্রা পরিবর্তিত হয়।
PPM এর পূর্ণরূপ হলো Parts Per Million. প্রতি 10 লক্ষ ভাগ দ্রবণে বা মিশ্রণে যত ভাগ দ্রব দ্রবীভূত থাকে, তাকে ppm এককে দ্রবণটির বা মিশ্রণটির ঘনমাত্রা বলে। একে 3 ভাবে প্রকাশ করা যায়।
১/ কঠিন মিশ্রণের ক্ষেত্রে (vw)
এক্ষেত্রে 1 ppm = 1 mg/kg = 1µg/g
২/ দ্রবণের ক্ষেত্রে (vw)
এক্ষেত্রে 1 ppm =1µg/mL
= 1mg/L
= 1mg/dm3
=1g/m3
এক্ষেত্রে সাধারণত দ্রাবক হিসেবে বিশুদ্ধ পানি ব্যবহৃত হয়। বিশুদ্ধ পানির ক্ষেত্রে 1mL পানির ভর 1gm ধরা হয়।
৩/ তরল মিশ্রণের ক্ষেত্রে (vw)
এক্ষেত্রে 1ppm=1μL/L(10−6=1μg)
1ppm=1061=1 g10−6 g=1 g1μg=1 mL1μg(1μg/mL)
প্রতি 100 কোটি ভাগ দ্রবণে বা মিশ্রণের মধ্যে যত ভাগ দ্রব দ্রবীভূত আছে, সে পরিমাণকে ppb এককে দ্রবণটির ঘনমাত্রা বলে। এর পূর্ণ নাম হল– Parts Per Billion.
মোলারিটি ( C ) =M×VW×1000
W = gm এককে দ্রবের ভর
V = দ্রবের আয়তন
M = মোলার ভর
C=M×1000W×10−3×1000
W = ppm এককে দ্রবের ভর
V = 1000mL
W=C×M×103PPm
C=M×1000W×1000V=1000mLW=Cmol−1×Mgmol−1W=CMgL−1=C×M×103mgL−1=C×M×103PPmW=C×M×103PPm=C×M×106PPb=C×M×109PPt (Parts per trillion)
1. PPm = নমুনার ভর ( গ্রাম ) দ্রবের ভর ( গ্রাম ) ×106
2. PPm = নমুনার আয়তন (মিলিলিটার) দ্রবের ভর ( গ্রাম ) ×106
3. PPb = নমুনার ভর ( গ্রাম ) দ্রবের ভর ( গ্রাম ) ×109
4. PPb = নমুনার আয়তন (মিলিলিটার) দ্রবের ভর ( গ্রাম ) ×109
5. মোলারিটি থেকে PPM: W = C×M×103 PPm
6. মোলারিটি থেকে শতকরায় রূপান্তর : x=1000CM%
Cx=M×VW×1000=M×V10x×1000=1000CM%
6. শতকরা পরিমাণকে PPM এ প্রকাশঃ PPM এর পরিমাণ x=W%×106 ( W% = শতকরার পরিমাণ )
7. PPM কে শতকরা পরিমাণে প্রকাশ, 1 PPM = 0.0001%
নরমলিটি
মোলালিটি
মোলারিটি
কোনটিই নয়
রাসায়নিক সমীকরণের মাধ্যমে গ্যাসের মোলার আয়তন গণনা করা হয় স্ট্যান্ডার্ড টেম্পারেচার এবং প্রেশার (STP) এর শর্তে, যেখানে ১ মোল গ্যাসের আয়তন ২২.৪ লিটার।
রাসায়নিক সমীকরণের মাধ্যমে গ্যাসের মোলার আয়তন গণনার জন্য মৌলিক সমীকরণ ব্যবহার করা হয়:
মোলার আয়তন (V)=গ্যাসের মোল সংখ্যা (n)×22.4
ধরা যাক, দস্তা এবং হাইড্রোক্লোরিক অ্যাসিড বিক্রিয়া করে হাইড্রোজেন গ্যাস উৎপন্ন করছে।
সমীকরণ:
Zn+2HCl→ZnCl2+H2
যদি ১ গ্রাম দস্তা ব্যবহার করা হয়, তবে হাইড্রোজেন গ্যাসের আয়তন গণনা করা যায়।
ধরা যাক, ক্যালসিয়াম কার্বোনেটকে হাইড্রোক্লোরিক অ্যাসিডের সাথে বিক্রিয়া করানো হয়।
সমীকরণ:
CaCO3+2HCl→CaCl2+CO2+H2O
যদি ১০ গ্রাম ক্যালসিয়াম কার্বোনেট ব্যবহার করা হয়, তবে উৎপন্ন কার্বন ডাই অক্সাইডের আয়তন গণনা করা যাবে।
ধরা যাক, নাইট্রোজেন এবং হাইড্রোজেনের বিক্রিয়া থেকে অ্যামোনিয়া উৎপন্ন করা হয়।
সমীকরণ:
N2+3H2→2NH3
যদি ১ মোল নাইট্রোজেন এবং ৩ মোল হাইড্রোজেন ব্যবহার করা হয়, উৎপন্ন অ্যামোনিয়া গ্যাসের আয়তন গণনা করা যাবে।
রাসায়নিক সমীকরণ থেকে গ্যাসের মোল সংখ্যা নির্ণয় করে মোলার আয়তনের সূত্র প্রয়োগের মাধ্যমে STP শর্তে গ্যাসের আয়তন গণনা করা হয়।
যে সমীকরণের মাধ্যমে কেবল অংশগ্রহণকারী আয়ন সমূহের দ্বারা বিক্রিয়াটি উপস্থাপন করা হয়, তাকে আয়নিক সমীকরণ বলে। যেমন: Mg(s)+2H+(aq)Mg2+(aq)+H2(g)
গে-লুসাকের সূত্র অনুযায়ী, স্থির আয়তনে গ্যাসের চাপ এবং তাপমাত্রার মধ্যে সরল আনুপাতিক সম্পর্ক থাকে।
গাণিতিকভাবে:
P1T1=P2T2
যেখানে,
১. উদাহরণ:
একটি গ্যাসের প্রাথমিক চাপ P1=2,atm এবং প্রাথমিক তাপমাত্রা T1=300,K। যদি তাপমাত্রা T2=450,K করা হয়, তবে নতুন চাপ (P2) কত হবে?
সমাধান:
P1T1=P2T2
P2=P1×T2T1
P2=2×450300=3,atm
উত্তর: P2=3,atm।
২. উদাহরণ:
গ্যাসের প্রাথমিক চাপ P1=5,atm এবং প্রাথমিক তাপমাত্রা T1=350,K। যদি চাপ P2=10,atm হয়, তবে তাপমাত্রা T2 কত হবে?
সমাধান:
P1T1=P2T2
T2=P2×T1P1
T2=10×3505=700,K
উত্তর: T2=700,K।
রাসায়নিক সমীকরণের মাধ্যমে উৎপন্ন গ্যাসের আয়তন নির্ণয় করতে মূলত গ্যাসের মোল সংখ্যা এবং আদর্শ গ্যাস সূত্র ব্যবহার করা হয়।
আদর্শ গ্যাস সূত্রটি হলো:
PV=nRT
এখানে,
প্রথমে সমীকরণটি ব্যালেন্স করতে হবে। উদাহরণস্বরূপ, যদি আমরা CaCO3 এর তাপীয় বিশ্লেষণ করি:
CaCO3→CaO+CO2
এখানে ১ মোল CaCO3 থেকে ১ মোল CO2 উৎপন্ন হয়।
প্রতিক্রিয়ায় অংশগ্রহণকারী যৌগের মোল সংখ্যা নির্ণয় করা হয়। উদাহরণস্বরূপ, যদি CaCO3 এর 10 গ্রাম নেওয়া হয়, তবে এর মোল সংখ্যা:
Moles of CaCO3=Given massMolar mass=10100=0.1 mol
সমীকরণ অনুসারে, ০.১ মোল CaCO3 থেকে ০.১ মোল CO2 উৎপন্ন হবে।
CO2 এর আয়তন নির্ণয় করতে আদর্শ গ্যাস সূত্র ব্যবহার করা হয়:
V=nRTP
যদি T=298K, P=1atm, এবং n=0.1mol হয়, তবে:
V=(0.1)(0.0821)(298)1=2.45,liters
অতএব, উৎপন্ন CO2-এর আয়তন হবে ২.৪৫ লিটার।
গ্যাস উৎপাদনের প্রক্রিয়ায় বিক্রিয়কের ভর থেকে উৎপাদ গ্যাসের ভর এবং আয়তন গণনা করা একটি গুরুত্বপূর্ণ পদক্ষেপ। এর মাধ্যমে আমরা গ্যাসের পরিমাণ এবং তার ফিজিক্যাল অবস্থা (যেমন চাপ, তাপমাত্রা) নির্ধারণ করতে পারি। এটি একটি রাসায়নিক প্রতিক্রিয়া এবং গ্যাসের বৈশিষ্ট্য অনুসরণ করে সঠিক হিসাব করতে সাহায্য করে।
গ্যাসের ভর গণনা করার জন্য প্রথমে আমরা চিনি যে, বিক্রিয়ক গ্যাসটি নির্দিষ্ট পরিমাণ উৎপন্ন করছে। সাধারণত, এটি একটি স্টোকিওমেট্রিক সমীকরণ ব্যবহার করে নির্ধারণ করা হয়। গ্যাসের উৎপাদন পরিমাণের ভিত্তিতে গ্যাসের ভর হিসাব করা হয়:
m=M×nV
এখানে,
গ্যাসের আয়তন গণনা করতে আমরা আইডিয়াল গ্যাসের সমীকরণ ব্যবহার করি:
PV=nRT
এখানে,
এই সমীকরণ ব্যবহার করে, গ্যাসের আয়তন নির্ধারণ করা যেতে পারে।
বিক্রিয়কের ভর থেকে উৎপাদ গ্যাসের ভর এবং আয়তন গণনা করার প্রক্রিয়া বিভিন্ন ফিজিক্যাল গুণাবলী ও রাসায়নিক প্রতিক্রিয়ার ভিত্তিতে করা হয়। এটি সঠিকভাবে গণনা করতে প্রয়োজনীয় উপাদান যেমন মোলার ভর, চাপ, তাপমাত্রা ইত্যাদি বিবেচনায় নিতে হয়।
কোনো রাসায়নিক বিক্রিয়ায় গ্যাসের আয়তন নির্ণয় করার জন্য সাধারণত গ্যাসের পরিমাণ এবং অবস্থান সম্পর্কিত তথ্য প্রয়োজন। গ্যাসের আয়তন নির্ণয়ের জন্য বিভিন্ন সূত্র ব্যবহৃত হয়, যেমন আইডিয়াল গ্যাস সূত্র, সোপানের সূত্র ইত্যাদি। এখানে আইডিয়াল গ্যাস সূত্রের সাহায্যে গ্যাসের আয়তন নির্ণয়ের একটি প্রক্রিয়া আলোচনা করা হবে।
আইডিয়াল গ্যাসের জন্য ব্যবহৃত সূত্র হল:
PV=nRT
এখানে:
গ্যাসের আয়তন নির্ণয়ের জন্য এই সূত্র থেকে V কে আলাদা করা হয়:
V=nRTP
যে কোনো রাসায়নিক বিক্রিয়া যেখানে গ্যাস উৎপাদিত হয়, সেখানে গ্যাসের পরিমাণ নির্ধারণের জন্য নিম্নলিখিত ধাপ অনুসরণ করতে হবে:
ধরা যাক, 1 মোল হাইড্রোজেন গ্যাস (H2) 298 K তাপমাত্রা এবং 1 atm চাপের অধীনে। আইডিয়াল গ্যাস সূত্র অনুসারে, গ্যাসের আয়তন হবে:
V=nRTP
এখানে n=1, R=0.0821,L·atm/(mol·K), T=298,K, এবং P=1,atm দেওয়া হলে, গ্যাসের আয়তন হবে:
V=(1)(0.0821)(298)1=24.5,L
তাহলে, 1 মোল হাইড্রোজেন গ্যাসের আয়তন 24.5 লিটার।
রাসায়নিক বিক্রিয়ায় উৎপাদিত গ্যাসের আয়তন নির্ণয় করার জন্য আইডিয়াল গ্যাস সূত্র ব্যবহার করা হয়, যা গ্যাসের পরিমাণ (মোল সংখ্যা), তাপমাত্রা এবং চাপের উপর ভিত্তি করে গ্যাসের আয়তন নির্ধারণ করে।
মোলার দ্রবণ বা মোলারিটি বলতে কী বুঝ?
নির্দিষ্ট তাপমাত্রায় 1 লিটার দ্রবণে 1 মোল দ্রব দ্রবীভূত থাকলে, তাকে ঐ তাপমাত্রায় ঐ দ্রবের মোলার দ্রবণ বলে।
নির্দিষ্ট তাপমাত্রায় প্রতি লিটার দ্রবণে দ্রবীভূত দ্রবের মোল সংখ্যাকে ঐ দ্রবণের মোলারিটি বলে। একে M দ্বারা প্রকাশ করা হয়। এর একক হল molL−1
মোলারিটি, S = লিটার দ্রবণের আয়তন মোল এককে দ্রবের ভর
S=Vn=M×VWn=MW(এখানে V লিটার এককে)
বা, S=M×VW×1000 [ এক্ষেত্রে V এর আয়তন mL এ বসানো হয় ]
ডেসিমোলার, সেমিমোলার এবং সেন্টিমোলার দ্রবণ বলতে কি বুঝ?
নির্দিষ্ট তাপমাত্রায় –
1L দ্রবণে 1 mol বা 98g H2SO4 থাকলে তাকে 1M বা মোলার দ্রবণ বলে।
1L দ্রবণে 0.5 mol বা 49g H2SO4 থাকলে তাকে 0.5M বা সেমিমোলার দ্রবণ বলে।
1L দ্রবণে 0.1 mol বা 9.8g H2SO4 থাকলে তাকে 0.1M বা ডেসিমোলার দ্রবণ বলে।
1L দ্রবণে 0.01 mol বা 0.98g H2SO4 থাকলে তাকে 0.01M বা সেন্টিমোলার দ্রবণ বলে।
প্রমাণ দ্রবণ বলতে কী বুঝ?
নির্দিষ্ট তাপমাত্রায় নির্দিষ্ট আয়তনের দ্রবণে দ্রবীভূত দ্রবের পরিমাণ জানা থাকলে তাকে ঐ দ্রবের প্রমাণ দ্রবণ বলে। যেমন– 0.1M Na2CO3 দ্রবণ একটি প্রমাণ দ্রবণ। কারণ নির্দিষ্ট তাপমাত্রায় দ্রবণে কী পরিমাণ দ্রব আছে তা জানা যায়। যেমন – নির্দিষ্ট তাপমাত্রায় প্রতি লিটার দ্রবণে 0.1mol বা 10.6 gm Na2CO3 দ্রবীভূত আছে।
ডেসিমোলার Na2CO3দ্রবণ একটি প্রমাণ দ্রবণ কেন?
মোলার দ্রবণ একটি প্রমাণ দ্রবণ – ব্যাখ্যা কর।
মোলার দ্রবনে নির্দিষ্ট তাপমাত্রায় 1L দ্রবণে 1mol Na2CO3 দ্রব দ্রবীভূত আছে। যেহেতু নির্দিষ্ট আয়তনে দ্রবীভূত দ্রবের পরিমাণ জানা আছে, তাই এটি একটি প্রমাণ দ্রবণ হবে। এর মোলার দ্রবণ অর্থাৎ 1L দ্রবণে 1mol বা 106 gm Na2CO3 দ্রবীভুত আছে।
মোলাল দ্রবণ এবং মোলালিটি বলতে কী বুঝ?
প্রতি kg দ্রাবকে 1mol পরিমাণ দ্রব দ্রবীভূত থাকলে দ্রবণটিকে ঐ দ্রবের মোলাল দ্রবণ বলে। তাছাড়া প্রতি kg দ্রাবকে দ্রবীভূত দ্রবের মোল সংখ্যাকে ঐ দ্রবণের মোলালিটি বলে। একে m দ্বারা প্রকাশ করা হয়।
এর একক হল molkg−1
m=kg এককে দ্রাবকের পরিমাণ মোল এককে দ্রবের পরিমাণ
মোলার দ্রবণ বা মোলারিটি বলতে কী বুঝ?
নির্দিষ্ট তাপমাত্রায় 1 লিটার দ্রবণে 1 মোল দ্রব দ্রবীভূত থাকলে, তাকে ঐ তাপমাত্রায় ঐ দ্রবের মোলার দ্রবণ বলে।
নির্দিষ্ট তাপমাত্রায় প্রতি লিটার দ্রবণে দ্রবীভূত দ্রবের মোল সংখ্যাকে ঐ দ্রবণের মোলারিটি বলে। একে M দ্বারা প্রকাশ করা হয়। এর একক হল molL−1
মোলারিটি, S = লিটার দ্রবণের আয়তন মোল এককে দ্রবের ভর
S=Vn=M×VWn=MW(এখানে V লিটার এককে)
বা, S=M×VW×1000 [ এক্ষেত্রে V এর আয়তন mL এ বসানো হয় ]
ডেসিমোলার, সেমিমোলার এবং সেন্টিমোলার দ্রবণ বলতে কি বুঝ?
নির্দিষ্ট তাপমাত্রায় –
1L দ্রবণে 1 mol বা 98g H2SO4 থাকলে তাকে 1M বা মোলার দ্রবণ বলে।
1L দ্রবণে 0.5 mol বা 49g H2SO4 থাকলে তাকে 0.5M বা সেমিমোলার দ্রবণ বলে।
1L দ্রবণে 0.1 mol বা 9.8g H2SO4 থাকলে তাকে 0.1M বা ডেসিমোলার দ্রবণ বলে।
1L দ্রবণে 0.01 mol বা 0.98g H2SO4 থাকলে তাকে 0.01M বা সেন্টিমোলার দ্রবণ বলে।
প্রমাণ দ্রবণ বলতে কী বুঝ?
নির্দিষ্ট তাপমাত্রায় নির্দিষ্ট আয়তনের দ্রবণে দ্রবীভূত দ্রবের পরিমাণ জানা থাকলে তাকে ঐ দ্রবের প্রমাণ দ্রবণ বলে। যেমন– 0.1M Na2CO3 দ্রবণ একটি প্রমাণ দ্রবণ। কারণ নির্দিষ্ট তাপমাত্রায় দ্রবণে কী পরিমাণ দ্রব আছে তা জানা যায়। যেমন – নির্দিষ্ট তাপমাত্রায় প্রতি লিটার দ্রবণে 0.1mol বা 10.6 gm Na2CO3 দ্রবীভূত আছে।
ডেসিমোলার Na2CO3দ্রবণ একটি প্রমাণ দ্রবণ কেন?
মোলার দ্রবণ একটি প্রমাণ দ্রবণ – ব্যাখ্যা কর।
মোলার দ্রবনে নির্দিষ্ট তাপমাত্রায় 1L দ্রবণে 1mol Na2CO3 দ্রব দ্রবীভূত আছে। যেহেতু নির্দিষ্ট আয়তনে দ্রবীভূত দ্রবের পরিমাণ জানা আছে, তাই এটি একটি প্রমাণ দ্রবণ হবে। এর মোলার দ্রবণ অর্থাৎ 1L দ্রবণে 1mol বা 106 gm Na2CO3 দ্রবীভুত আছে।
মোলাল দ্রবণ এবং মোলালিটি বলতে কী বুঝ?
প্রতি kg দ্রাবকে 1mol পরিমাণ দ্রব দ্রবীভূত থাকলে দ্রবণটিকে ঐ দ্রবের মোলাল দ্রবণ বলে। তাছাড়া প্রতি kg দ্রাবকে দ্রবীভূত দ্রবের মোল সংখ্যাকে ঐ দ্রবণের মোলালিটি বলে। একে m দ্বারা প্রকাশ করা হয়।
এর একক হল molkg−1
m=kg এককে দ্রাবকের পরিমাণ মোল এককে দ্রবের পরিমাণ
মোলারিটি (M) হল একটি দ্রবণীয় পদার্থের ঘনত্ব, যা একটি দ্রবণে দ্রাবক বা দ্রব্যের পরিমাণের সাথে সম্পর্কিত। মোলারিটি সাধারণত "মোল প্রতি লিটার" (mol/L) হিসেবে পরিমাপ করা হয়। তবে, মাঝে মাঝে এই মোলারিটিকে শতকরা (percentage) বা পিপিএম (parts per million) এককে রূপান্তর করা প্রয়োজন হয়।
শতকরা এককে রূপান্তরের জন্য, প্রথমে মোলারিটি (M) এবং দ্রবণের মোট ভর জানা প্রয়োজন। মোলারিটিকে শতকরা এককে রূপান্তরের জন্য নিম্নলিখিত সূত্র ব্যবহার করা যেতে পারে:
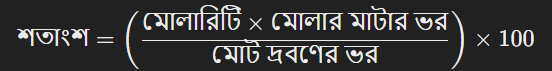
এখানে,
পিপিএম (parts per million) এককে রূপান্তরের জন্য নিম্নলিখিত সূত্র ব্যবহার করা হয়:
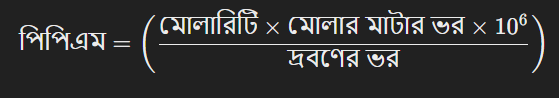
এখানে,
মোলারিটিকে শতকরা ও পিপিএম এককে রূপান্তরের প্রক্রিয়াটি নির্ভর করে দ্রবণের ভর, দ্রব্যের মোলার মাটার ভর, এবং মোলারিটি পরিমাপের উপরে। এর মাধ্যমে সহজেই একটি দ্রবণের ঘনত্ব বিভিন্ন এককে রূপান্তর করা সম্ভব।
দ্রবণের মোলারিটি ও শতকরা হার (percentage by mass) একে অপরের সাথে সম্পর্কিত। এই সম্পর্কটি সাধারাণত কেমিস্ট্রি ও রাসায়নিক বিশ্লেষণে গুরুত্বপূর্ণ।
মোলারিটি একটি দ্রবণে দ্রবিত পদার্থের পরিমাণের পরিমাপ। এটি গ্যালন বা লিটার প্রতি মোল হিসাব করা হয়, এবং এর একক সাধারণত M (মোল/লিটার) থাকে।
এদিকে, শতকরা হার (percentage by mass) হলো দ্রবণে দ্রবিত পদার্থের ভর (mass) কে দ্রবণের মোট ভরের সাথে তুলনা করে শতকরা হিসাবে প্রকাশ করা।
মোলারিটি থেকে শতকরা হার রূপান্তর:

এখানে,
শতকরা হার থেকে মোলারিটি রূপান্তর:
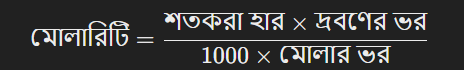
ধরা যাক, ১০০ গ্রাম দ্রবণে ৫ গ্রাম NaCl (সোডিয়াম ক্লোরাইড) দ্রবীভূত করা হয়েছে। NaCl এর মোলার ভর ৫৮.৫৫ গ্রাম/মোল।
প্রথমে, শতকরা হার বের করতে হবে:
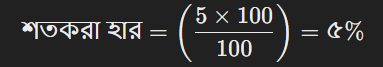
এখন, মোলারিটি বের করা:
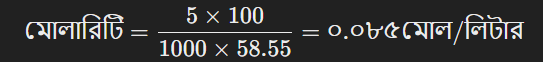
এই রূপান্তরগুলি দ্রবণের মোলারিটি ও শতকরা হারের মধ্যে সম্পর্ক বুঝতে সাহায্য করে।
মোলারিটি এবং শতকরা হারের মধ্যে সম্পর্ক সরল গাণিতিক সূত্রের মাধ্যমে রূপান্তরিত হতে পারে, যা রাসায়নিক গবেষণা এবং দৈনন্দিন জীবনে দ্রবণ তৈরি করতে ব্যবহৃত হয়।
PM বলতে কী বুঝ? (106)
PPM এর পূর্ণরূপ হলো Parts Per Million. প্রতি 10 লক্ষ ভাগ দ্রবণে বা মিশ্রণে যত ভাগ দ্রব দ্রবীভূত থাকে, তাকে ppm এককে দ্রবণটির বা মিশ্রণটির ঘনমাত্রা বলে। একে 3 ভাবে প্রকাশ করা যায়।
১/ কঠিন মিশ্রণের ক্ষেত্রে (vw)
এক্ষেত্রে 1 ppm = 1 mg/kg = 1µg/g
২/ দ্রবণের ক্ষেত্রে (vw)
এক্ষেত্রে 1 ppm =1µg/mL
= 1mg/L
= 1mg/dm3
=1g/m3
এক্ষেত্রে সাধারণত দ্রাবক হিসেবে বিশুদ্ধ পানি ব্যবহৃত হয়। বিশুদ্ধ পানির ক্ষেত্রে 1mL পানির ভর 1gm ধরা হয়।
৩/ তরল মিশ্রণের ক্ষেত্রে (vw)
এক্ষেত্রে 1ppm=1μL/L(10−6=1μg)
1ppm=1061=1 g10−6 g=1 g1μg=1 mL1μg(1μg/mL)
=1 kg10−6 g×103 g
=1 kg10−3 g
=1 kg1mg=1 L1mg
=103 L103mg=1 m31 g( g/m3)
1 ppb বলতে কী বুঝ?
প্রতি 100 কোটি ভাগ দ্রবণে বা মিশ্রণের মধ্যে যত ভাগ দ্রব দ্রবীভূত আছে, সে পরিমাণকে ppb এককে দ্রবণটির ঘনমাত্রা বলে। এর পূর্ণ নাম হল– Parts Per Billion.
( 1 ppb = 1 µg/L )
PPM , PPb, PPt এককে প্রকাশের পদ্ধতি বা মোলারিটিকে ppm, ppb তে প্রকাশ।
মোলারিটি ( C ) =M×VW×1000
W = gm এককে দ্রবের ভর
V = দ্রবের আয়তন
M = মোলার ভর
C=M×1000W×10−3×1000
W = ppm এককে দ্রবের ভর
V = 1000mL
W=C×M×103PPm
C=M×1000W×1000V=1000mLW=Cmol−1×Mgmol−1W=CMgL−1=C×M×103mgL−1=C×M×103PPmW=C×M×103PPm=C×M×106PPb=C×M×109PPt (Parts per trillion)
কতিপয় সূত্র জেনে রাখা ভালোঃ
1. PPm = নমুনার ভর ( গ্রাম ) দ্রবের ভর ( গ্রাম ) ×106
2. PPm = নমুনার আয়তন (মিলিলিটার) দ্রবের ভর ( গ্রাম ) ×106
3. PPb = নমুনার ভর ( গ্রাম ) দ্রবের ভর ( গ্রাম ) ×109
4. PPb = নমুনার আয়তন (মিলিলিটার) দ্রবের ভর ( গ্রাম ) ×109
5. মোলারিটি থেকে PPM: W = C×M×103 PPm
6. মোলারিটি থেকে শতকরায় রূপান্তর : x=1000CM%
Cx=M×VW×1000=M×V10x×1000=1000CM%
6. শতকরা পরিমাণকে PPM এ প্রকাশঃ PPM এর পরিমাণ x=W%×106 ( W% = শতকরার পরিমাণ )
7. PPM কে শতকরা পরিমাণে প্রকাশ, 1 PPM = 0.0001%
এসিড-ক্ষার প্রশমন বিক্রিয়া (Acid-Base Neutralization Reaction) হলো একটি রসায়ন বিক্রিয়া যেখানে একটি এসিড এবং একটি ক্ষার একে অপরকে প্রশমন করে। এই বিক্রিয়ায় এসিডের হাইড্রোজেন আয়ন (H⁺) এবং ক্ষারের হাইড্রোক্সাইড আয়ন (OH⁻) একে অপরকে মিশে পানি (H₂O) তৈরি করে, এবং একটি লবণ (Salt) উৎপন্ন হয়।
এসিড-ক্ষার প্রশমন বিক্রিয়ার উদাহরণ:
HCl+NaOH→NaCl+H2O
এখানে হাইড্রোক্লোরিক এসিড (HCl) এবং সোডিয়াম হাইড্রোক্সাইড (NaOH) একে অপরকে প্রতিক্রিয়া করে সোডিয়াম ক্লোরাইড (NaCl) এবং পানি (H₂O) তৈরি করেছে।
প্রশমন বিন্দু (Neutralization Point):
প্রশমন বিন্দু বা ন্যূনতম বিন্দু হলো সেই অবস্থান যেখানে এসিড এবং ক্ষারের পরিমাণ একে অপরের সাথে সমান হয়ে যায় এবং সম্পূর্ণভাবে একটি নিরপেক্ষ দ্রবণ তৈরি হয়। এই বিন্দুতে দ্রবণে কোনো অতিরিক্ত এসিড বা ক্ষার থাকে না, এবং pH মান সাধারণত ৭ এর কাছাকাছি থাকে।
এসিড-ক্ষার প্রশমন বিক্রিয়ায় pH মানের পরিবর্তন নির্ধারণ করতে বিভিন্ন কেমিক্যাল সূচক ব্যবহার করা হয়। উদাহরণস্বরূপ, ফেনলফথ্যালিন বা মিথাইল অরেঞ্জ বিভিন্ন pH এর জন্য রঙ পরিবর্তন করে, যা প্রশমন বিন্দু সঠিকভাবে চিহ্নিত করতে সাহায্য করে।
এসিড এবং ক্ষার যৌথভাবে একে অপরকে প্রশমন করে একটি স্নিগ্ধ বিক্রিয়া তৈরি করে। এই বিক্রিয়াটি এসিড এবং ক্ষারের মধ্যকার প্রতিক্রিয়া, যার মাধ্যমে সঠিক পরিমাণে পানি এবং একটি লবণ সৃষ্টি হয়। এটি একটি নিরপেক্ষীকরণ বিক্রিয়া হিসেবে পরিচিত।
এসিড ক্ষার প্রশমন বিক্রিয়ার সাধারণ আকার:
H++OH−→H2O
এটি একটি সাধারণ এসিড-ক্ষার প্রতিক্রিয়া, যেখানে এসিড থেকে H+ আয়ন এবং ক্ষার থেকে OH− আয়ন প্রতিক্রিয়া করে পানি তৈরি করে।
এসিড এবং ক্ষারের প্রশমন বিক্রিয়া বোঝার জন্য রাসায়নিক গণনা ব্যবহার করা হয়। এতে এসিড এবং ক্ষারের পরিমাণের গাণিতিক সম্পর্ক নির্ণয় করা হয়, যেমনঃ
যখন এসিড এবং ক্ষার সমান অনুপাতে প্রতিক্রিয়া করে, তখন তাদের মোলারিটি এবং ভলিউমের গাণিতিক সম্পর্ক পরিমাপ করতে হবে। এই ধরনের গণনা সাধারণত নিরপেক্ষীকরণের পরিমাণ নির্ণয় করার জন্য ব্যবহার করা হয়।
এসিড-ক্ষার প্রশমন বিক্রিয়া একটি মৌলিক রাসায়নিক প্রতিক্রিয়া, যা তাপমাত্রা ও চাপের নির্দিষ্ট শর্তে ঘটে। রাসায়নিক গণনা দ্বারা আমরা এসিড এবং ক্ষারের পরিমাণের সম্পর্ক নির্ধারণ করতে পারি, যা বিভিন্ন রাসায়নিক প্রক্রিয়া এবং পরীক্ষায় প্রয়োগ করা হয়।
জারণ বিজারণ (Oxidation-Reduction)
প্রশ্নঃ জারণ ও বিজারণের ইলেকট্রনীয় মতবাদ উদাহরণসহ আলোচনা কর।
উত্তরঃ আধুনিককালে ইলেকট্রন বর্জন ও গ্রহণের ভিত্তিতে জারণ বিজারণ বিক্রিয়ার ব্যাখ্যাকে জারণ বিজারণের মতবাদ বলে।
জারণঃ ইলেকট্রনীয় মতবাদ অনুসারে যে রাসায়নিক বিক্রিয়ায় কোন পরমাণু বা মূলক বা আয়ন এক বা একাধিক ইলেকট্রন দান করে সেই বিক্রিয়াকে জারণ বলে। কিন্তু যে রাসায়নিক সত্ত্বা e− দান করে তাকে বিজারক পদার্থ বলে।
বিজারণঃ ইলেকট্রনীয় মতবাদ অনুসারে যে রাসায়নিক বিক্রিয়ায় কোন পরমাণু বা মূলক বা আয়ন এক বা একাধিক ইলেকট্রন গ্রহণ করে সেই বিক্রিয়াকে বিজারণ বলে। কিন্তু যে রাসায়নিক সত্ত্বা e− গ্রহণ করে তাকে জারক পদার্থ বলে।
উদাহরণঃ সোডিয়াম ও ক্লোরিন এর পারস্পারিক বিক্রিয়ায় NaCl উৎপন্ন হয়।
2Na+Cl2⟶2NaCl
এই বিক্রিয়াটি জারণ বিজারণের ইলেকট্রনীয় মতবাদের আলোকে নিম্নে ব্যাখ্যা করা হলঃ
ইলেকট্রনীয় মতবাদ অনুসারে, এই বিক্রিয়ায় প্রত্যেক সোডিয়াম (Na) পরমাণু এর সর্ববহিঃস্থ স্তর হতে একটি ইলেকট্রন দান করে নিজে জারিত হয়ে সোডিয়াম আয়নে (Na+) পরিণত হয়। অপরদিকে প্রত্যেক ক্লোরিন পরমাণু সোডিয়াম প্রদত্ত একটি ইলেকট্রন গ্রহণ করে নিজে বিজারিত হয়ে ক্লোরাইড আয়নে (Cl−) পরিণত হয়। অতঃপর ভিন্নধর্মী উভয় আয়ন যুক্ত হয়ে NaCl গঠন করে।
জারণঃ 2Na (বিজারক) ⟶2Na++2e−
বিজারণঃ Cl2 (জারক) +2e−⟶2Cl−
(+) করে, 2Na+Cl2⟶2Na+Cl−বা 2NaCl
কাজেই দেখা যায় যে, কোন পদার্থ জারিত হওয়ার সময় ইলেকট্রন ত্যাগ করে এবং বিজারিত হওয়ার সময় ইলেকট্রন গ্রহণ করে। জারণ বিক্রিয়ায় বিজারক যতটি ইলেকট্রন দান করে বিজারণ বিক্রিয়ায় জারক ততটি ইলেকট্রন গ্রহণ করে। অর্থাৎ জারণ ও বিজারণ বিক্রিয়ায় ইলেকট্রন আদান প্রদান ঘটে। ইহা ইলেকট্রনীয় মতবাদের মূল কথা।
প্রশ্নঃ ইলেকট্রনীয় মতবাদ অনুসারে ব্যাখ্যা কর যে, জারণ ও বিজারণ যুগপৎ সংঘটিত হয়।
উত্তরঃ জারণ ও বিজারণ প্রক্রিয়া দুইটি পরস্পরের বিপরীত ও সম্পূরক। যখন কোন জারণ ক্রিয়া ঘটে তখন তার অনুবর্তী বিজারণ এবং যখন কোনো বিজারণ ক্রিয়া ঘটে তখন তার অনুবর্তী ক্রিয়াও অবশ্যই ঘটে।
ইলেকট্রনীয় মতবাদ অনুসারে জারণ হচ্ছে ইলেকট্রন দান প্রক্রিয়া এবং বিজারণ হচ্ছে ইলেকট্রন গ্রহণ প্রক্রিয়া। নিম্নের উদাহরণের সাহায্যে ইলেকট্রনীয় মতবাদের ভিত্তিতে জারণ বিজারণ যুগপৎ সংঘটিত হয়। উক্তিটির যথার্থতা প্রমাণ করা হল–
সোডিয়াম (Na) ও ক্লোরিন (Cl2) পারস্পারিক বিক্রিয়ায় সোডিয়াম ক্লোরাইড (NaCl) উৎপন্ন করে।
বিক্রিয়াঃ 2Na(বিজারক) ⟶2Na++2e−
Cl2 (জারক) +2e−⟶2Cl−
(+) করে, 2Na+Cl2⟶2Na+Cl− বা 2NaCl
এ বিক্রিয়ায় ক্লোরিন সোডিয়ামকে জারিত করে NaCl এ পরিণত করে। বিক্রিয়াকালে প্রত্যেক Na পরমাণু একটি করে ইলেকট্রন দান করে। কাজেই এটি একটি জারণ প্রক্রিয়া। আবার প্রত্যেক ক্লোরিন পরমাণু একটি একটি করে ইলেকট্রন গ্রহণ করে। সুতরাং ক্লোরিন জারক পদার্থ। বিজারণের সংজ্ঞা মতে, বিজারণ প্রক্রিয়া হচ্ছে ইলেকট্রন গ্রহণ প্রক্রিয়া। যেহেতু বিক্রিয়াকালে ক্লোরিন ইলেকট্রন গ্রহণ করে সেহেতু জারক পদার্থ জারণকালে নিজে বিজারিত হয়ে যায়।
আবার, সোডিয়াম ক্লোরিনকে বিজারিত করে NaCl এ পরিণত করে। এটি একটি বিজারণ বিক্রিয়া। কারণ, বিক্রিয়াকালে ক্লোরিন পরমাণু ইলেকট্রন গ্রহণ করে। Na বিজারক পদার্থ কারণ ইহা ইলেকট্রন দান করে, জারণের সজ্ঞা মতে, জারণ প্রক্রিয়া হচ্ছে ইলেকট্রন দান প্রক্রিয়া। যেহেতু সোডিয়াম ইলেকট্রন দান করে সেহেতু বিজারক পদার্থ বিজারণকালে নিজে জারিত হয়ে যায়। সুতরাং দেখা যায় যে, জারক পদার্থ জারণকালে নিজে বিজারিত হয়ে যায় এবং বিজারক পদার্থ বিজারণকালে নিজে জারিত হয়ে যায়। অর্থাৎ জারণ ছাড়া বিজারণ এবং বিজারণ ছাড়া শুধুমাত্র জারণ সংঘটিত হয় না, সুতরাং জারণ ও বিজারণ যুগপৎ সংঘটিত হয়।
প্রশ্নঃ জারণ সংখ্যা বলতে কী বুঝ? জারণ সংখ্যা কিরূপে নির্ণয় করা হয়।
উত্তরঃ কোন যৌগে একটি পরমাণু যে অবস্থায় আছে, মৌলের মুক্ত অবস্থা হতে সে অবস্থায় আসতে পরমাণুটিকে যতসংখ্যক ইলেকট্রক বর্জন বা গ্রহণ বা শেয়ার করতে হয়, সেই সংখ্যাকে ঐ যৌগে ঐ পরমাণুর জারণ সংখ্যা বলে। কোন যৌগে কোনো মৌলের উপরিস্থিত চার্জ সংখ্যাকে ঐ যৌগে মৌলটির জারণ সংখ্যা বলে।
ইলেকট্রন দান করলে জারণ সংখ্যা ধনাত্মক এবং ইলেকট্রন গ্রহণ করলে জারণ সংখ্যা ঋণাত্মক হয়। প্রকৃতপক্ষে কোন যৌগে কোন মৌল কতসংখ্যক কিরূপ তড়িৎ আধানযুক্ত, জারণ সংখ্যা তাই নির্দেশ করে।
উদাহরণঃ আয়নিক যৌগে NaCl গঠনকালে Na পরমাণু থেকে একটি ইলেকট্রন অপসারিত হয়েছে। সুতরাং এই যৌগে Na এর জারণ সংখ্যা +1 । অপরদিকে Cl পরমাণু একটি ইলেকট্রন গ্রহণ করেছে। অপসারণের বিপরীত প্রক্রিয়া ঘটেছে বলেই এই যৌগে Cl এর জারণ সংখ্যা -1 । অবশ্য সমযোজী যৌগের ক্ষেত্রে জারণ সংখ্যা নির্ণয়ের সময়, শেয়ারকৃত ইলেকট্রনের প্রতি যে মৌলের আসক্তি বেশি তার জারণমান “-” চিহ্ন এবং যে মৌলের আসক্তি কম তার জারণ মান “+” চিহ্ন দ্বারা প্রকাশ করা হয়। যেমন – HCl এ H এর জারণ মান +1 এবং Cl এর জারণ সংখ্যা -1
জারণ সংখ্যা নির্ণয়ের নিয়মঃ
১। চার্জ নিরপেক্ষ যৌগে উহার মৌলসমূহের জারণ সংখ্যার বীজগণিতীয় যোগফল শূণ্য হবে। আয়নের বেলায় এই যোগফল আয়নের চার্জের সমান হয়।
২। অক্সিজেনের জারণ সংখ্যা পার অক্সাইড -1, সুপারঅক্সাইড (KO2) – ½ ধরা হয়, অক্সাইডে -2 ধরা হয়।
৩। স্বাভাবিক মুক্ত অবস্থায় সব মৌলের জারণ সংখ্যা শূণ্য।
৪। আন্তঃ হ্যালোজেন যৌগসমূহে অধিকতর তড়িৎ ঋণাত্মক মৌলের জারণ সংখ্যা -1 .
৫। ক্ষারীয় ধাতুসমূহের জারণ সংখ্যা +1 এবং মৃৎক্ষার ধাতুসমূহের জারণ সংখ্যা +2.
প্রশ্নঃ জারণ সংখ্যা ও যোজনীর মধ্যে পার্থক্য লেখ।
উত্তরঃ জারণ সংখ্যা ও যোজনীর মধ্যে পার্থক্য নিম্নে দেওয়া হলঃ

কতিপয় জারক ও বিজারক পদার্থের উদাহরণ
জারক পদার্থ : (ইলেকট্রন গ্রহণকারী)
1. Fe3++e−→Fe2+
(FeCl3)
2. Sn4++2e−→Sn2+⟶+2e−Sn
3.O22−+2e−→2O2−
(পারঅক্সাইড আয়ন) (H2O2)
4. Mn+7O4−8+5e−+8H+→Mn2++4H2O
(KMnO4)
5. Cr2+12O7−2+6e−+14H+→2Cr3++7H2O
(K2Cr2O7)
6. I2+2e−→2I−
7. Cu2++e−→Cu+
(CuSO4)
তবে MnO4ক্ষারীয় মাধ্যমে MnO4 এবং নিরপেক্ষ মাধ্যমে MnO2এ পরিবর্তন হয় এবং Mn এর জারণসংখ্যা যথাক্রমে +6 এবং +4 হয়।
কতিপয় বিজারক পদার্থের উদাহরণ এবং বিক্রিয়ার প্রকৃতি :
বিজারক পদার্থ (ইলেকট্রন দানকারী)
1. Fe2++→Fe3++e−(FeSO4,FeCl2)
2.Sn2+→Sn4++2e−(SnCl2)
3. 2I−→I2+2e−(KI)
4. C+62O+632−(অক্সালেট আয়ন)→2C+4O+42+2e− (H2C2O4,Na2C2O4)
5. 2S+42O+632−(থায়োসালফেট আয়ন) →S+104O−1262−+2e−(Na2S2O3)
(টেট্রাথায়োনেট আয়ন)
6. S2−→S+2e−(H2 S)
7. O22−→O2+2e−
H2 S2O8 অণুতে (পারসালফিউরিক এসিড) S এর জারণ সংখ্যা কত?
+1×2+x×2+(−1)×2+6×(−2)=0
বা, 2x – 12 = 0
∴x = + 6
জারণ সংখ্যা নির্ণয়ের কয়েকটি ব্যতিক্রম :
১. CrO5 অণুতে 𝐂𝐫 এর জারণ সংখ্যা : প্রচলিত পদ্ধতি অনুযায়ী CrO5 (পারক্রোমিক অক্সাইড) অণুতে Cr এর জারণ সংখ্যা +10 [CrxO−25,x−10=0⇒x=+10] হওয়া উচিত। কিন্তু Cr এর 3d অরবিটালে 5টি এবং 4s অরবিটালে 1টি ইলেকট্রন থাকে। সুতরাং Cr এর জারণ সংখ্যা কখনোই +6 এর বেশি হওয়া সম্ভব নয়।
CrO5এর গঠনাকৃতি থেকে দেখানো যায় Cr এর জারণ সংখ্যা প্রকৃতপক্ষে +6। ধরা যাক, CrO5 অণুতে Cr এর জারণ সংখ্যা = x।
∴x +1(−2) + 4(−1) = 0 (O এর জন্য) (O−O বন্ধনে আবদ্ধ O পরমাণুগুলির জন্য)
∴x = +6. সুতরাং CrO5অণুতে Cr এর জারণ সংখ্যা = +6.
২. H2SO5অণুতে S এর জারণ সংখ্যা : প্রচলিত পদ্ধতি অনুযায়ী, H2SO5(পারঅক্সোসালফিউরিক এসিড) অণুতে S এর জারণ সংখ্যা +8 [H2 SO5,x+2−10=0⇒x=+8] হওয়া উচিত। কিন্তু S এর সর্ববহিস্থ কক্ষে 6টি ইলেকট্রন থাকে। সুতরাং S এর জারণ সংখ্যা কখনোই +6 এর বেশি হওয়া সম্ভব নয়। H2SO5এর গঠনাকৃতি থেকে বোঝা যায় S এর জারণ সংখ্যা প্রকৃতপক্ষে +6। ধরা যাক, H2S2O5অণুতে S এর জারণ সংখ্যা = 𝑥।
2(+1) +x +2(−1) +3(−2)=0
(H পরমাণুগুলির জন্য) (O – O) বন্ধনে আবদ্ধ O- পরমাণুগুলির জন্য) (অপর O- পরমাণুগুলির জন্য)
∴x=+6
সুতরাং, H2SO5 অণুতে S এর জারণ সংখ্যা +6।
3. Na2 S4O6 অণুতে S এর জারণ সংখ্যা : প্রচলিত পদ্ধতি অনুযায়ী, Na2 S4O6 অণুতে S এর জারণ সংখ্যার গড়মান +2.5 [Na+12 S+x4O−26,2(+l)+4x+6(−2)=0⇒x=+2.5] হওয়া উচিত। কিন্তু এক্ষেত্রে দুটি S পরমাণু পরস্পরের সঙ্গে সমযোজী বন্ধনে আবদ্ধ, তাদের জারণ সংখ্যা শূন্য হয়। বাকি দুটি S পরমাণুর ক্ষেত্রে জারণ সংখ্যা x হলে,
x×2+2×0 + 6(−2) + 2(+1) = ০
(S এর জন্য) (S-S এর জন্য) (O এর জন্য Na এর জন্য)
বা, 2𝑥−12+2=0, 𝑥=+5
সুতরাং, Na2 S4O6অণুতে যে দুটি S পরমাণু পরস্পরের সঙ্গে সমযোজী বন্ধনে আবদ্ধ তাদের জারণ সংখ্যা শূন্য এবং বাকি দুটি S পরমাণুর প্রতিটির জারণ সংখ্যা +5.
4. Fe3O4 অণুতে 𝐅𝐞 এর জারণ সংখ্যা : প্রচলিত পদ্ধতি অনুযায়ী Fe3O4তে Fe এর জারণ সংখ্যা +8/3[3𝑥+4(−2)=0 বা 𝑥=8/3] হওয়া উচিত। এই মান Fe3O4 তে Fe এর জারণ সংখ্যা গড় মান প্রকাশ করে। প্রকৃতপক্ষে Fe3O4 হল FeO ও Fe3O4 এর মিশ্রণ যার সংযুক্তি হল FeO. Fe3O4। FeO তে Fe এর জারণ সংখ্যা হল +2 এবং Fe3O4 তে Fe এর জারণ সংখ্যা হল +3।
প্রশ্ন : জারণ অর্ধ বিক্রিয়া এবং বিজারণ অর্ধ বিক্রিয়ার সংজ্ঞা দাও।
জারণ অর্ধ বিক্রিয়া : কোন জারণ বিজারণ বিক্রিয়ার যে অর্ধাংশে জারণ ঘটে তাকে জারণ অর্ধ বিক্রিয়া বলে। এক্ষেত্রে বিজারক পদার্থ ইলেকট্রন দান করে জারিত হয়।
বিজারণ অর্ধ বিক্রিয়া : কোন জারণ বিজারণ বিক্রিয়ার যে অর্ধাংশে বিজারণ ঘটে তাকে বিজারণ অর্ধ বিক্রিয়া বলে। এক্ষেত্রে জারক পদার্থ ইলেকট্রন গ্রহণ করে বিজারিত হয়।
উদারহণ : সোডিয়াম পরমাণু ও ক্লোরিন পরমাণু বিক্রিয়া কালে সোডিয়াম পরমাণু ইলেকট্রন ত্যাগ করে সোডিয়াম আয়নে জারিত হয়, এটি জারণ অর্ধ বিক্রিয়া। ক্লোরিন পরমাণু ইলেকট্রন গ্রহণ করে ক্লোরাইড আয়নে বিজারিত হয়, এটি বিজারণ অর্ধ বিক্রিয়া।
Na→Na++e− [জারণ অর্ধ-বিক্রিয়া]
Cl+e→Cl− [বিজারণ অর্ধ-বিক্রিয়া]
যোগ করে, Na+Cl→Na+Cl− [জারণ বিজারণ বিক্রিয়া]
প্রশ্ন: কপার সালফেট এবং পটাশিয়াম আয়োডাইডের বিক্রিয়াটি অর্ধবিক্রিয়ার সাহায্যে দেখাও।
উত্তর: কপার সালফেট (CuSO4) এবং পটাশিয়াম আয়োডাইডের (KI) এর বিক্রিয়ায় CuSO4(Cu2+)একটি জারক এবংKI(I−)একটি বিজারক পদার্থ। আধুনিক রীতি মতে, যে সকল মূলক বা আয়নের জারণ সংখ্যার কোন পরিবর্তন হয় না তাদেরকে দর্শক আয়ন বলে এবং এদেরকে আয়নিক বিক্রিয়ার সমীকরণে দেখানো হয় না। এক্ষেত্রে Cu2+ এবং I− বিক্রিয়ার অংশগ্রহণ করে।
এক্ষেত্রে ঘটমান অর্ধবিক্রিয়াগুলো নিম্নরূপ:
জারণ অর্ধবিক্রিয়া : 2I−(aq)→I2+2e−………(i)
বিজারণ অর্ধবিক্রিয়া: 2Cu2+(aq)+2e−→Cu22+(aq) বা 2Cu1+(aq)………(ii)
(i) নং ও (ii) নং যোগ করে পাই,
2Cu2+(aq)+2I−(aq)→I2+Cu22+(aq) বা 2Cu1+(aq)
প্রয়োজনীয় আয়ন সরবরাহ করলে বিক্রিয়াটি নিম্নরূপ হবে-
2CuSO4(aq)+4KI(aq)→I2+Cu2I2 বা 2CuI(aq)+2 K2SO4(aq) (aq)
ইহাই প্রদত্ত বিক্রিয়ার প্রকৃত জারণ-বিজারণ অর্ধবিক্রিয়ার সমীকরণ।
প্রশ্ন: অম্লীয় মাধ্যমে K2Cr2O7এর পটাশিয়াম আয়োডাইডের বিক্রিয়া জারণ বিজারণের সাহায্যে সমতাসহ লিখ।
উত্তর: অম্লীয় মাধ্যমে পটাশিয়াম ডাইক্রোমেট (K2Cr2O7) এবং পটাশিয়াম আয়োডাইডের (KI) বিক্রিয়ায় K2Cr2O7(Cr2O72−) একটি জারক এবং KI(I−) একটি বিজারক পদার্থ। আধুনিক রীতি মতে, যেসব মূলক বা আয়ন এর জারণ সংখ্যার কোন পরিবর্তন ঘটে না তাদেরকে আয়নিক বিক্রিয়া সমীকরণে দেখানো হয় না। এক্ষেত্রে Cr2O72−এবং I–বিক্রিয়ায় অংশগ্রহণ করে। এখানে K+ আয়ন এবং SO42− দর্শক আয়ন।
এক্ষেত্রে সংঘটিত অর্ধবিক্রিয়াগুলো নিম্নরূপ:
জারণ অর্ধবিক্রিয়া : 2I−(aq)→I2+2e−……… (i)
বিজারণ অর্ধবিক্রিয়া : Cr2O72−(aq)+6e−+14H+→2Cr3+(aq)+7H2O……… (ii)
(ii) নং এ প্রদত্ত H+ এসিড হতে আসে, যা Cr2O72− এর অক্সিজেনকে পানিতে পরিণত করে। এখন ইলেকট্রনের সমতা বিধানের জন্য (i) নং কে 3 দ্বারা গুণ করে অতঃপর (ii) নং এর সাথে যোগ করে পাই-
Cr2O72−(aq)+6I−(aq)+14H+(aq)→2Cr3+(aq)+3I2+7H2O
বিক্রিয়াটি যদি H2SO4 এর উপস্থিতিতে ঘটে তবে প্রয়োজনীয় আয়ন সরবরাহ করলে বিক্রিয়াটি নিম্নরূপ হবে-
K2Cr2O7+6KI+7H2SO4→4 K2SO4+Cr2(SO4)3+3I2+7H2O
যদি HCl হয় তবে বিক্রিয়াটি হবে-
K2Cr2O7+6KI+14HCl→8KCl+2CrCl3+3I2+7H2O
প্রশ্ন: অম্লীয় পটাশিয়াম ডাইক্রোমেটের সাথে ফেরাস লবণের জারণ বিজারণ অর্ধ বিক্রিয়ার সাহায্যে দেখাও।
উত্তর: অম্লীয় পটাশিয়াম ডাইক্রোমেটের (K2Cr2O7) সাথে ফেরাস লবণ যেমন- ফেরাস সালফেটের (FeSO4) বিক্রিয়ায় K2Cr2O7(Cr2O72−) জারক পদার্থ এবং FeSO4(Fe2) একটি বিজারক পদার্থ। আধুনিক নিয়ম মতে, যে সকল মূলক বা আয়নের সংখ্যার কোন পরিবর্তন ঘটে না তাদেরকে আয়নিক বিক্রিয়ার সমীকরণে দেখানো হয় না। এক্ষেত্রে Cr2O72− এবং Fe2+ বিক্রিয়া করে । এখানে K+ আয়ন এবং SO42−দর্শক আয়ন।
এক্ষেত্রে ঘটমান অর্ধবিক্রিয়াগুলো নিম্নরূপ:
জারণ অর্ধবিক্রিয়া : Fe2+(aq)→Fe3+(aq)+e−……… (i)
বিজারণ অর্ধবিক্রিয়া : Cr2O72−(aq)+6e−+14H+→2Cr3+(aq)+7H2O………(ii)
(ii) নং এ প্রদত্ত H+এসিড হতে আসে, যা Cr2O72−এর অক্সিজেনকে পানিতে পরিণত করে। এখন ইলেকট্রনের সমতা বিধানের জন্য। (i) নং কে 6 দ্বারা গুণ করে অতঃপর (ii) নং এর সাথে যোগ করে পাই-
6Fe2+(aq)+Cr2O72−(aq)+14H+(aq)→6Fe3+(aq)+2Cr3+(aq)+7H2O
বিক্রিয়াটি যদি H2SO4 এর উপস্থিতিতে ঘটে তবে প্রয়োজনীয় আয়ন সরবরাহ করলে বিক্রিয়াটি নিম্নরূপ হবে-
6FeSO4+K2Cr2O7+7H2SO4→3Fe2(SO4)3+Cr2(SO4)3+7H2O+K2SO4
প্রশ্ন: নিম্নলিখিত সমীকরণগুলোকে জারণ-বিজারণ বা রিডক্স সমীকরণে পৃথক করে লিখ।
(ক) 6Fe2++Cr2O72−+14H+→6Fe3++2Cr3++7H2O
উত্তর: প্রদত্ত বিক্রিয়াটি নিম্নরূপ-
6Fe2++Cr2O72−14H+→6Fe3++2Cr3++7H2O
এই বিক্রিয়ায় এসিডের (H+) উপস্থিতিতে ডাইক্রোমেট আয়ন (Cr2O72−) জারক হিসেবে কাজ করে। কারণ এখানে Cr এর জারণ সংখ্যা হ্রাস পায়। আবার Fe2+বিজারক হিসাবে কাজ করে। কারণ Fe2+ এর জারণ সংখ্যা বৃদ্ধি পায়।
এক্ষেত্রে ঘটমান অর্ধবিক্রিয়াগুলো নিম্নরূপ:
জারণ অর্ধবিক্রিয়া: Fe2+(aq)→Fe3+(aq)+e−………… (i)
বিজারণ অর্ধবিক্রিয়া: 6Fe2+(aq)+6e−+14H+→2Cr3++7H2O………..(ii)
ইলেকট্রনের সমতার জন্য (i) নং কে 6 দ্বারা গুণ করে অতঃপর প্রাপ্ত সমীকরণকে (ii) নং সাথে যোগ করে পাই
6Fe2++Cr2O72−+14H+→6Fe3++2Cr3++7H2O
(খ) 2Cu2++4I−→Cu2l2
উত্তর: এক্ষেত্রে প্রদত্ত বিক্রিয়াটি নিম্নরূপ-
2Cu2++4I−→Cu2l2
কপারের জারণ সংখ্যা হ্রাস পাওয়ায় এ ক্ষেত্রে Cu আয়ন একটি জারক পদার্থ এবং I− আয়ন এর জারণ সংখ্যা বৃদ্ধি পাওয়ায় এটি বিজারক হিসেবে কাজ করে।
এক্ষেত্রে ঘটমান অর্ধবিক্রিয়াগুলো নিম্নরূপঃ
জারণ অর্ধবিক্রিয়াঃ 4I−→I2+2I−+2e−………………(i)
বিজারণ অর্ধর্বিক্রিয়াঃ 2Cu2++2e−→Cu22+⋯⋯⋯⋯(ii)
ইলেকট্রনের সমতা বিধানের জন্য (i)+ (ii)→2Cu2++4I−→I2+Cu22++2I−
বা, 2Cu2++4I−→Cu2l2+I2
(গ) 2 S2O32−(aq)+I2(aq)→S4O62−(aq)+2I−(aq)
উত্তর: এক্ষেত্রে প্রদত্ত বিক্রিয়াটি নিম্নরূপঃ
2 S2O32−(aq)+I2(aq)→S4O62−(aq)+2I−(aq)
S এর জারণ সংখ্যা বৃদ্ধি পাওয়ায় এক্ষেত্রে একটি বিজারক পদার্থ এবং আয়োডিনের জারণ সংখ্যা হ্রাস পাওয়ায় একটি জারক পদার্থ হিসেবে এ বিক্রিয়ায় অংশগ্রহণ করে।
এক্ষেত্রে ঘটমান অর্ধমান বিক্রিয়াগুলো নিম্নরূপ :
জারণ অর্ধবিক্রিয়াঃ 2 S2O32−(aq)→S4O62−(aq)+2e−(aq)……(i)
বিজারণ অর্ধবিক্রিয়া : I2(aq)+2e−→2I−………(ii)
(i)+ (ii)→ 2 S2O32−(aq)+I2(aq)→S4O62−(aq)+2I−(aq)
(ঘ) KMnO4+H2SO4+FeSO4→Fe2(SO4)3+K2SO4+MnSO4+H2O
উত্তরঃ প্রদত্ত বিক্রিয়াটি নিম্নরূপ-
KMnO4+H2SO4+FeSO4→Fe2(SO4)3+K2SO4+MnSO4+H2O
আয়রনের (Fe) জারণ সংখ্যা বৃদ্ধি পাওয়ায়FeSO4 একটি বিজারক পদার্থ। পক্ষান্তরে KMnO4(MnO4−) এ Mn এর জারণ সংখ্যা হাস পাওয়ায় +7 হতে +2 হওয়ায় ) KMnO4বা MnO4− একটি জারক পদার্থ। আধুনিক নিয়ম মতে, যে সব আয়ন বা মূলকের জারণ সংখ্যা মানের কোন পরিবর্তন ঘটে না তাদেরকে আয়নিক সমীকরণে দেখানো হয় না। এক্ষেত্রে Fe2+ এবং MnO4−এর মধ্যে বিক্রিয়া ঘটে।
এক্ষেত্রে ঘটমান অর্ধবিক্রিয়াগুলো নিম্নরূপঃ
জারণ অর্ধবিক্রিয়া : Fe2+(aq)→Fe3+(aq)+e−………… (i)
বিজারণ অর্ধবিক্রিয়া : MnO4−(aq) +5e−+8H+→Mn2+(aq)+4H2O(l)………… (ii)
(ii) নং সমীকরণে প্রদত্ত আয়ন এসিড হতে আসে এবং এর অক্সিজেনকে পানিতে পরিণত করে। এখন ইলেকট্রনের সমতা বিধানের জন্য (i) নং কে 5 দ্বারা গুণ করে অতঃপর প্রাপ্ত সমীকরণকে (ii) নং এর সাথে যোগ করে পাই-
5Fe2++MnO4−+8H+→5Fe3++Mn2++4H2O
H2SO4এসিডের উপস্থিতিতে বিক্রিয়াটি নিম্নরূপে পুর্ণ-সমতাকরণের মাধ্যমে নিম্নে দেওয়া হল-
10FeSO4+2KMnO4+8H2SO4→5Fe2(SO4)3+2MnSO4+K2SO4+8H2O
(ঙ) 5C2O42−+2MnO4−+16H+→2Mn2++8H2O+10CO2
উত্তর : প্রদত্ত বিক্রিয়াটি নিম্নরূপ-
5C2O42−+2MnO4−+16H+→2Mn2++8H2O+10CO2
এই বিক্রিয়ায় (H+) এসিডের উপস্থিতিতে পারম্যাঙ্গানেট আয়ন (MnO4−) জারক হিসেবে কাজ করে। কারণ এখানে Mn এর জারণের সংখ্যা হ্রাস পায়। আবার অক্সালেট আয়ন (C2O42−) এর C এর জারণ সংখ্যা +3 হতে +4 এ বৃদ্ধি পাওয়ায় আয়নটি বিজারক হিসেবে কাজ করে।
এক্ষেত্রে ঘটমান অর্ধবিক্রিয়াগুলো নিম্নরূপ:
জারণ অর্ধবিক্রিয়া: C2O42−→2CO2+2e−…………… (i)
বিজারণ অর্ধবিক্রিয়া: MnO4−+5e−+8H+→Mn2++4H2O………(ii)
ইলেকট্রনের সমতা বিধানের জন্য {(i)×5}+{(ii)×2}
5C2O42−+2MnO4−+16H+→2Mn2++8H2O+10CO2
প্রশ্ন: অম্লীয় পটাশিয়াম পারম্যাঙ্গানেট দ্রবণের সাথে হাইড্রোজেন পার অক্সাইডের বিক্রিয়া সমতাসহ লিখ।
উত্তর: অম্লীয় পটাশিয়াম পারম্যাঙ্গানেট (KMnO4) দ্রবণের সাথে হাইড্রোজেন পারঅক্সাইড (H2O2) এর বিক্রিয়ায় KMnO4(MnO4−)একটি জারক এবং H2O2(O2−)একটি বিজারক পদার্থ । আধুনিক নিয়ম মতে, যে সব মূলক বা আয়নের জারণ সংখ্যা কোন পরিবর্তন হয় না তাদেরকে আয়নিক সমীকরণে দেখানো হয় না .
এক্ষেত্রে ঘটমান অর্ধবিক্রিয়াগুলো নিম্নরূপ :
জারণ অর্ধবিক্রিয়া : O22−→O2+2e−…………. (i)
বিজারণ অর্ধবিক্রিয়া : MnO4−+5e−+8H+→Mn2++4H2O ………… (ii)
ইলেকট্রনের সমতা বিধানের জন্য– {ix5}+{(ii)x2}
5O22−+2MnO4−+16H+→5O2+Mn2++4H2O
H2SO4 এসিডের উপস্থিতিতে ঘটলে এবং প্রয়োজনীয় আয়ন সরবরাহের পর বিক্রিয়া নিম্নরূপে লেখা হয়–
5H2O2+2KMnO4+3H2SO4→5O2+2KMnO4+K2SO4+8H2O
প্রশ্ন: MnO4+Br−+H+→MnO2+BrO3+H2O
জারণ অর্ধ বিক্রিয়া : Br−+3H2O→BrO3+6H++6e−………(i)
বিজারণ অর্ধ বিক্রিয়া : MnO4+4H++3e−→MnO2+2H2O………(ii)
(i)+(ii)x2→
Br−+2MnO4−+H2O→BrO3−+2MnO2+2H+
প্রশ্ন: KBrO+53+KBr−1+HCl→Br02+KCl+H2O
বা, BrO3−+Br−+H+→Br2+H2O
জারণ অর্ধ বিক্রিয়া : 2Br−→Br2+2e−………(i)
বিজারণ অর্ধ বিক্রিয়া : 2BrO3−+12H++10e−→Br2+6H2O……(ii)
(i)×5+(ii)→
2BrO3−+12H++10Br−→6Br2+6H2O
বা, BrO3−+6H++5Br−→3Br2+3H2O
প্রশ্ন: K2Cr+122O7+H2SO4+NaCI−1→Cr+62(SO4)3+Cl20+Na2SO4+H2O
জারণ অর্ধ বিক্রিয়া : 2Cl−→Cl2+2e−………(i)
বিজারণ অর্ধ বিক্রিয়া : Cr2O72−+6e−+14H+→2Cr3++7H2O……… (ii)
(i)×3+(ii)→
6Cl−+Cr2O72−+14H+→2Cr3++3Cl2+7H2O
দর্শক আয়ন যোগ করে পাই,
6NaCl+K2Cr2O7+7H2SO4→Cr2(SO4)3+3Cl2+7H2O+3Na2SO4+K2SO4
প্রশ্নঃ জারণ সংখ্যা বলতে কী বুঝ? জারণ সংখ্যা কিরূপে নির্ণয় করা হয়।
উত্তরঃ কোন যৌগে একটি পরমাণু যে অবস্থায় আছে, মৌলের মুক্ত অবস্থা হতে সে অবস্থায় আসতে পরমাণুটিকে যতসংখ্যক ইলেকট্রক বর্জন বা গ্রহণ বা শেয়ার করতে হয়, সেই সংখ্যাকে ঐ যৌগে ঐ পরমাণুর জারণ সংখ্যা বলে। কোন যৌগে কোনো মৌলের উপরিস্থিত চার্জ সংখ্যাকে ঐ যৌগে মৌলটির জারণ সংখ্যা বলে।
ইলেকট্রন দান করলে জারণ সংখ্যা ধনাত্মক এবং ইলেকট্রন গ্রহণ করলে জারণ সংখ্যা ঋণাত্মক হয়। প্রকৃতপক্ষে কোন যৌগে কোন মৌল কতসংখ্যক কিরূপ তড়িৎ আধানযুক্ত, জারণ সংখ্যা তাই নির্দেশ করে।
উদাহরণঃ আয়নিক যৌগে NaCl গঠনকালে Na পরমাণু থেকে একটি ইলেকট্রন অপসারিত হয়েছে। সুতরাং এই যৌগে Na এর জারণ সংখ্যা +1 । অপরদিকে Cl পরমাণু একটি ইলেকট্রন গ্রহণ করেছে। অপসারণের বিপরীত প্রক্রিয়া ঘটেছে বলেই এই যৌগে Cl এর জারণ সংখ্যা -1 । অবশ্য সমযোজী যৌগের ক্ষেত্রে জারণ সংখ্যা নির্ণয়ের সময়, শেয়ারকৃত ইলেকট্রনের প্রতি যে মৌলের আসক্তি বেশি তার জারণমান “-” চিহ্ন এবং যে মৌলের আসক্তি কম তার জারণ মান “+” চিহ্ন দ্বারা প্রকাশ করা হয়। যেমন – HCl এ H এর জারণ মান +1 এবং Cl এর জারণ সংখ্যা -1
জারণ সংখ্যা নির্ণয়ের নিয়মঃ
১। চার্জ নিরপেক্ষ যৌগে উহার মৌলসমূহের জারণ সংখ্যার বীজগণিতীয় যোগফল শূণ্য হবে। আয়নের বেলায় এই যোগফল আয়নের চার্জের সমান হয়।
২। অক্সিজেনের জারণ সংখ্যা পার অক্সাইড -1, সুপারঅক্সাইড (KO2) – ½ ধরা হয়, অক্সাইডে -2 ধরা হয়।
৩। স্বাভাবিক মুক্ত অবস্থায় সব মৌলের জারণ সংখ্যা শূণ্য।
৪। আন্তঃ হ্যালোজেন যৌগসমূহে অধিকতর তড়িৎ ঋণাত্মক মৌলের জারণ সংখ্যা -1 .
৫। ক্ষারীয় ধাতুসমূহের জারণ সংখ্যা +1 এবং মৃৎক্ষার ধাতুসমূহের জারণ সংখ্যা +2.
প্রশ্নঃ জারণ সংখ্যা ও যোজনীর মধ্যে পার্থক্য লেখ।
উত্তরঃ জারণ সংখ্যা ও যোজনীর মধ্যে পার্থক্য নিম্নে দেওয়া হলঃ

কতিপয় জারক ও বিজারক পদার্থের উদাহরণ
জারক পদার্থ : (ইলেকট্রন গ্রহণকারী)
1. Fe3++e−→Fe2+
(FeCl3)
2. Sn4++2e−→Sn2+⟶+2e−Sn
3.O22−+2e−→2O2−
(পারঅক্সাইড আয়ন) (H2O2)
4. Mn+7O4−8+5e−+8H+→Mn2++4H2O
(KMnO4)
5. Cr2+12O7−2+6e−+14H+→2Cr3++7H2O
(K2Cr2O7)
6. I2+2e−→2I−
7. Cu2++e−→Cu+
(CuSO4)
তবে MnO4ক্ষারীয় মাধ্যমে MnO4 এবং নিরপেক্ষ মাধ্যমে MnO2এ পরিবর্তন হয় এর জারণসংখ্যা যথাক্রমে +6 এবং +4 হয়।
রিডক্স বিক্রিয়া (Redox reaction) এমন একটি প্রক্রিয়া, যেখানে একটি যৌগের ইলেকট্রন অন্য একটি যৌগের মধ্যে স্থানান্তরিত হয়। এটি সাধারণত অক্সিডেশন এবং রিডাকশন প্রক্রিয়া সমন্বয়ে ঘটে। রিডক্স বিক্রিয়ায় গুরুত্বপূর্ণ দুটি উপাদান থাকে: জারক (oxidizing agent) এবং বিজারক (reducing agent)। এই দুটি উপাদান একে অপরের বিরুদ্ধে কাজ করে থাকে, যেখানে জারক বিজারক থেকে ইলেকট্রন গ্রহণ করে এবং বিজারক জারককে ইলেকট্রন প্রদান করে।
রিডক্স বিক্রিয়ায় জারক এবং বিজারক শনাক্তকরণের জন্য কিছু সাধারণ কৌশল ব্যবহার করা হয়:
উদাহরণস্বরূপ, যখন অক্সিজেন (O₂) এবং হাইড্রোজেন (H₂) রিডক্স বিক্রিয়ায় অংশগ্রহণ করে, অক্সিজেন ইলেকট্রন গ্রহণ করে, অর্থাৎ এটি জারক (oxidizing agent) হিসেবে কাজ করে, এবং হাইড্রোজেন ইলেকট্রন প্রদান করে, অর্থাৎ এটি বিজারক (reducing agent) হিসেবে কাজ করে।
সারাংশ
রিডক্স বিক্রিয়ায় জারক এবং বিজারক শনাক্তকরণের জন্য অক্সিডেশন সংখ্যা, ইলেকট্রন স্থানান্তর, এবং ভোল্টেজ পরিবর্তনের মাধ্যমে এই উপাদানগুলো সনাক্ত করা যায়। এই শনাক্তকরণ প্রক্রিয়া আমাদের রিডক্স বিক্রিয়ার প্রকৃতি এবং এর সংশ্লিষ্ট উপাদানগুলোর ভূমিকা বুঝতে সাহায্য করে।
জারণ-বিজারণ অর্ধবিক্রিয়া (Redox Half-Reactions) হলো রসায়নে এমন প্রক্রিয়া যা কোনো পদার্থের ইলেকট্রন হারানো (জারণ) বা গ্রহণ (বিজারণ) এর মাধ্যমে ঘটে। সাধারণভাবে, জারণ-বিজারণ অর্ধবিক্রিয়াকে দুটি আলাদা প্রতিক্রিয়া হিসেবে বিবেচনা করা হয়—একটি প্রতিক্রিয়ায় ইলেকট্রন হ্রাস পায় (বিজারণ) এবং অন্যটিতে ইলেকট্রন বৃদ্ধি পায় (জারণ)। এই দুটি অর্ধবিক্রিয়া একে অপরকে পরিপূরক করে।
জারণ হল এমন একটি প্রক্রিয়া যেখানে কোনো পদার্থ এক বা একাধিক ইলেকট্রন হারায়। এর ফলে পদার্থটির অক্সিডেশন অবস্থান বৃদ্ধি পায়। উদাহরণস্বরূপ, যদি এক্সিলনের (Zn) একটি অণু এক বা একাধিক ইলেকট্রন হারায়, তবে সেটি জারণ প্রক্রিয়ায় অংশ নেয়।
উদাহরণ:
Zn→Zn2++2e−
এখানে, জিঙ্ক (Zn) দুইটি ইলেকট্রন হারিয়ে ২+ আধান যুক্ত আয়নে পরিণত হয়।
বিজারণ হল এমন একটি প্রক্রিয়া যেখানে কোনো পদার্থ এক বা একাধিক ইলেকট্রন গ্রহণ করে। এর ফলে পদার্থটির অক্সিডেশন অবস্থান কমে যায়। উদাহরণস্বরূপ, যদি সোনা (Au) এক বা একাধিক ইলেকট্রন গ্রহণ করে, তবে সেটি বিজারণ প্রক্রিয়ায় অংশ নেয়।
উদাহরণ:
Cu2++2e−→Cu
এখানে, কপারের (Cu) আয়ন ২টি ইলেকট্রন গ্রহণ করে সোনা (Cu) অণুতে পরিণত হয়।
এই দুটি প্রক্রিয়া একে অপরকে পরিপূরক করে কাজ করে, কারণ কোনো পদার্থ একে অপরের সাথে সম্পর্কিত অবস্থায় থাকে। এক্ষেত্রে, একে অপরের অর্ধবিক্রিয়া বজায় রাখতে একটি পূর্ণবিক্রিয়া সম্পন্ন হয়।
জারণ-বিজারণ অর্ধবিক্রিয়া হলো রসায়নীয় প্রতিক্রিয়া যেখানে একে অপরের পরিপূরক হিসেবে দুটি আলাদা প্রতিক্রিয়া ঘটে—একটি জারণ এবং অন্যটি বিজারণ। প্রতিটি প্রতিক্রিয়া পদার্থের ইলেকট্রন হারানো বা গ্রহণ করার মাধ্যমে ঘটে, এবং এই দুইটি প্রক্রিয়া মিলেই একটি পূর্ণবিক্রিয়া সৃষ্টি করে।
জারণ-বিজারণ (Oxidation-Reduction বা Redox) রাসায়নিক প্রতিক্রিয়া হলো এমন একটি প্রক্রিয়া যেখানে এক উপাদান ইলেকট্রন হারিয়ে জারণ হয় এবং অন্য উপাদান সেই ইলেকট্রন গ্রহণ করে বিজারণ ঘটে। এটি সাধারণত একে অপরের সাথে সম্পর্কিত দুটি প্রতিক্রিয়া হিসেবে ঘটে। কোনো প্রতিক্রিয়ায় একটি পদার্থ ইলেকট্রন হারায় (জারণ) এবং অন্যটি ইলেকট্রন গ্রহণ করে (বিজারণ)। এই ধরণের প্রতিক্রিয়া জীববিজ্ঞান, পরিবেশবিজ্ঞান, ও অন্যান্য বিজ্ঞান শাখায় গুরুত্বপূর্ণ ভূমিকা রাখে।
জারণ-প্রক্রিয়া এবং বিজারণ-প্রক্রিয়ার মূল ধারণাগুলি পর্যালোচনা করা গুরুত্বপূর্ণ। যে পদার্থ ইলেকট্রন হারায়, তা জারণ হয় এবং এই পদার্থের অক্সিডেশন রাষ্ট্র (oxidation state) বৃদ্ধি পায়। অন্যদিকে, বিজারণ ঘটে যখন কোনো পদার্থ ইলেকট্রন গ্রহণ করে এবং তার অক্সিডেশন রাষ্ট্র কমে যায়।
১. অক্সিডেশন রাষ্ট্র নির্ধারণ: প্রতিটি উপাদানের অক্সিডেশন রাষ্ট্র বা সংখ্যাটি নির্ধারণ করা প্রথম পদক্ষেপ। এটি রাসায়নিক প্রতিক্রিয়ায় কোনো পদার্থ কতটুকু ইলেকট্রন হারিয়েছে বা গ্রহণ করেছে তা নির্ধারণ করতে সাহায্য করে।
২. সামঞ্জস্যপূর্ণ ইলেকট্রন হস্তান্তর: প্রতিটি পদার্থের জারণ ও বিজারণের মাধ্যমে ইলেকট্রন হস্তান্তরের ভারসাম্য রক্ষা করা হয়। এটি নিশ্চিত করতে হবে যে প্রতিটি ইলেকট্রন গ্রহণ এবং হস্তান্তরের প্রক্রিয়া সঠিকভাবে সমন্বিত হয়েছে।
৩. সমীকরণ তৈরি করা: প্রতিক্রিয়ার প্রতিটি পদার্থের সংখ্যা এবং তাদের অক্সিডেশন রাষ্ট্রের পরিবর্তন থেকে একটি ব্যালেন্সড সমীকরণ তৈরি করা হয়। এতে প্রতিটি পদার্থের পরিমাণ সঠিকভাবে গণনা করা হয়।
ধরা যাক, একটি সোজা জারণ-বিজারণ প্রতিক্রিয়া:
Cu+2Ag+→Cu2++2Ag
এই প্রতিক্রিয়ায়:
এছাড়া, প্রতিটি পদার্থের জন্য ইলেকট্রন হস্তান্তরের হিসাব করা হয়, যাতে প্রতিক্রিয়া সঠিকভাবে ভারসাম্যপূর্ণ হয়।
জারণ-বিজারণ ভিত্তিক রাসায়নিক গণনা একটি মৌলিক ও গুরুত্বপূর্ণ ধারণা যা রাসায়নিক প্রতিক্রিয়ার বিশ্লেষণে ব্যবহৃত হয়। এর মাধ্যমে আমরা পদার্থের অক্সিডেশন রাষ্ট্রের পরিবর্তন বুঝতে পারি এবং প্রতিক্রিয়াগুলির সঠিক গণনা করতে পারি।
যেসব পদার্থ নিজেদের রং পরিবর্তনের মাধ্যমে কোনো একটি বস্তু এসিড না ক্ষারক বা কোনোটিই নয় তা নির্দেশ করে তাদেরকে নির্দেশক বলে।
সুতরাং, নির্দেশক হলো রাসায়নিক পদার্থ যা কোনও প্রদত্ত দ্রবণটি অ্যাসিডিক, ক্ষারীয়, নিরেপক্ষ কিনা তা রং এর পরিবর্তন দেখিয়ে শনাক্ত করা হয়।
যেমন: লিটমাস কাগজ, মিথাইল অরেঞ্জ, ফেনোফথ্যালিন, মিথাইল রেড ইত্যাদি নির্দেশক হিসেবে ব্যবহৃত হয় ।
নির্দেশক কাকে বলে?
"যে পদার্থ তার নিজস্ব বর্ণ পরিবর্তন দ্বারা একটি দ্রবণ এসিডীয়, ক্ষারীয় না প্রশম তা নির্দেশ করে অথবা কোনো বিক্রিয়া শেষ বিন্দু নির্ধারন করে তাকে নির্দেশক বলে"
★বিভিন্ন নির্দেশকের ব্যবহার
১।তীব্র এসিড-মৃদু ক্ষার প্রকৃতির দ্রবণে উপযোগী নির্দেশক হল মিথাইল অরেঞ্জ ও মিথাইল রেড
২।মৃদু এসিড-তীব্র ক্ষার প্রকৃতির দ্রবণে উপযোগী নির্দেশক হল
ফেনফথ্যালিন ও লিটমাস
৩।তীব্র এসিড -তীব্র ক্ষার প্রকৃতির দ্রবণে উপযোগী নির্দেশক হল
সকল নির্দেশক
৪।মৃদু এসিড-মৃদু ক্ষার প্রকৃতির দ্রবণে কোনো উপযুক্ত নির্দেশক নেই।
★নির্দেশক সমূহের Ph range
1.থাইমাল ব্লু = 1.2-2.8
2.মিথাইল অরেঞ্জ =3.1-4.4
3.মিথাইল রেড =4.2-6.3
4.লিটমাস দ্রবণ =5.5-7.5
5.ফেনল রেড = 6.8-8.4
6.ক্রিসল রেড = 7.2-8.8
7.ফেনফথ্যালিন =8.3-10
ট্রাইটেশন একটি রসায়ন পদ্ধতি যার মাধ্যমে দ্রবণের ঘনমাত্রা (concentration) নির্ণয় করা হয়। এটি সাধারণত এসিড ও ক্ষারের পরিমাণ নির্ধারণের জন্য ব্যবহৃত হয়। এই পদ্ধতিতে, একটি আউটপুট দ্রবণকে একটি স্ট্যান্ডার্ড দ্রবণ (যে দ্রবণের ঘনমাত্রা জানা থাকে) দিয়ে প্রতিস্থাপন করা হয়, এবং প্রতিক্রিয়া সম্পন্ন হলে দ্রবণের পরিমাণ মাপা হয়।
গণনা:
C1V1=C2V2
যেখানে,
C1 এবং V1 হলো স্ট্যান্ডার্ড দ্রবণের ঘনমাত্রা এবং পরিমাণ,
C2 এবং V2 হলো অজানা দ্রবণের ঘনমাত্রা এবং পরিমাণ।
ট্রাইটেশন পদ্ধতি অজানা দ্রবণের এসিড বা ক্ষারের ঘনমাত্রা নির্ণয়ের একটি নির্ভরযোগ্য পদ্ধতি। এটি সহজ, দ্রুত এবং সঠিক পদ্ধতি হিসেবে ব্যবহৃত হয় যেখানে একটি স্ট্যান্ডার্ড দ্রবণ এবং ইন্ডিকেটর ব্যবহার করে একটি নির্দিষ্ট প্রতিক্রিয়া ঘটানো হয়।
আয়োডিমিতি এবং আয়োডোমিতি বলতে কি বুঝ?
আয়োডিমিতি (Iodimetry): প্রমাণ আয়োডিন দ্রবণের সাহায্যে বিজারক পদার্থের টাইট্রেশন করার মাধ্যমে বিজারক পদার্থের পরিমাণ নির্ধারণ পদ্ধতিকে আয়োডিমিতি বলে।
প্রমাণ আয়োডিন দ্রবণের সাহায্যে থায়োসালফেট সালফাইট, আর্সেনাইট ইত্যাদি বিজারক পদার্থের টাইট্রেশন দ্বারা এদের পরিমাণ নির্ণয় করা হয়।
উদাহরণ: প্রমাণ আয়োডিন দ্রবণ দ্বারা সোডিয়াম থায়োসালফেটের (Na2 S2O3) পরিমাণ নির্ণয় একটি আয়োডিমিতিক পদ্ধতিকে এক্ষেত্রে নিম্নরূপ বিক্রিয়া ঘটে-
2Na2 S2O3+I2→Na2 S4O6+2NaI
এক্ষেত্রে ঘটমান অর্ধবিক্রিয়াগুলো নিম্নরূপ:
জারণ অর্ধবিক্রিয়া: 2 S2O32−→S4O62−+2e−…………(i)
বিজারণ অর্ধবিক্রিয়া: I2+2e−→2I−…………(ii)
(i)+ (ii)→2 S2O32−+I2→S4O62−+2I−
আয়োডোমিতি (Iodometry) : কোন জারক পদার্থের দ্রবণের নির্দিষ্ট আয়নের সাথে আয়োডাইড লবণের বিক্রিয়ায় উৎপন্ন আয়োডিনকে প্রমাণ থায়োসালফেট দ্রবণ দ্বারা টাইট্রেশন করার মাধ্যমে মুক্ত I2 এর পরিমাণ নির্ণয় করে জারক পদার্থের পরিমাণ নির্ণয় করার পদ্ধতিতে আয়োডিমিতি বলে। এ প্রক্রিয়ায় নির্ধারিত আয়োডিনের পরিমাণ থেকে সংশ্লিষ্ট জারক যেমন- CuSO4,KMnO4 ইত্যাদির পরিমাণ নির্ণয় করা হয়।
উদাহরণ: নির্দিষ্ট পরিমাণ জারক পদার্থকে (CuSO4 এর দ্রবণ) কনিকেল ফ্লাকে নিয়ে এর মধ্যে অধিক KI যোগ করলে তুল্য পরিমাণ I2 মুক্ত হয়। পরে মুক্ত আয়োডিনকে প্রমান Na2 S2O3 দ্রবণ দ্বারা টাইট্রেশন করা হয়।
এক্ষেত্রে সংঘটিত বিক্রিয়াগুলো নিম্নরূপ-
2CuSO4+4KI→Cu2I2+I2+2 K2SO4…………… (i)
2Na2 S2O3+I2→Na2 S4O6+2NaI………… (ii)
(i) ও (ii) নং হতে-
2CuSO4≡I2≡2Na2 S2O3
বা, 1molNa2 S2O3≡1molCuSO4
≡1molCu2+
অর্থাৎ 1000 cm31MNa2 S2O3 দ্রবণ = 63.54g Cu2+
বা, 1 cm31MNa2 S2O3দ্রবণ = 0.006354g Cu2+
যদি মুক্ত আয়োডিন প্রশমনের জন্য y cm21MNa2 S2O3 দ্রবণ প্রয়োজন হয় তবে ycm31MNa2 S2O3 দ্রবণ = (0.006354×𝑦)g Cu2+। এ ধরনের টাইট্রেশনে স্টার্চ দ্রবণ নির্দেশক হিসেবে ব্যবহৃত হয়। এভাবে CuSO4 দ্রবণে Cu2+এর পরিমাপ নির্ণয় করা যায়।
বিয়ার ল্যাম্বার্ট সূত্রের সীমাবদ্ধতা লিখ।
দ্রবণের ঘনমালা 0.0001M – 0.01M এর মধ্যে সূত্র প্রযোজ্য। 0.1M এর বেশী হলে প্রযোজ্য নয়। উচ্চ ঘনমালায় H বন্ধন গঠন, দ্রাবকযুক্ত হওয়া, বা কোন রাসায়নিক কারণে ঘনমালার পরিবর্তন ঘটায় তা এ সূত্র মেনে চলেনা।
দ্রবণে উপাদানের মধ্যে সংযোজন এবং বিযোজন ঘটলে প্রযোজ্য নয়।
একবর্ণী আলোক না হলে প্রযোজ্য নয়।
আলো শোষণের পূর্বে প্রতিফলন যা বিচ্ছুরণ ঘটলে প্রযোজ্য নয়।
বিয়ার ল্যাম্বার্ট সূত্রের সাহায্যে কীরূপে অজানা ঘনমাত্রা নির্ণয় করা যায়?
এক্ষেত্রে একই দ্রবণের বিভিন্ন ঘনমাত্রায় প্রমাণ দ্রবণ নিয়ে একই পদ্ধতি ব্যবহার করে বিভিন্ন ঘনমাত্রায় Absorbance নির্ণয় করা হয়। অতঃপর Absorbance এর বিপরীতে অনুরূপ ঘনমাত্রার লেখচিত্র অঙ্কন করা হলে বিয়ার ল্যাম্বার্ট সমীকরণ মতে একটি মূলবিন্দুগামী সরলরেখা পাওয়া যাবে। নমুনা দ্রবণের ঘনমাত্রা যত বেশী হবে absorbance তত বেশী হবে। নমুনায় ব্যবহৃত cell যেহেতু নির্দিষ্ট তাই absorbance দ্রবণের ঘনমাত্রার সমানুপাতিক হবে।
অতঃপর আপাত ঘনমাত্রার দ্রবণ নিয়ে একই পদ্ধতিতে Absorbance মেপে লেখচিত্র থেকে সহজে ঘনমাত্রা নির্ণয় করা যায়। মনে করি, কোন পানির নমুনায় KNO3 এর পরিমাণ নির্ণয় করতে হবে।
এক্ষেত্রে প্রথমে KNO3 দ্রবণের 2, 4, 6, 8 ppm প্রভৃতি ঘনমাত্রার কয়েকটি দ্রবণ প্রস্তুত করে শোষণ করা হয়। অতঃপর এ সমস্ত দ্রবণের মধ্যে দিয়ে আলো আপতিত করে বিভিন্ন ঘনমাত্রার Absorbance লিপিবদ্ধ করা হয়। মনে করি, এদের বিশেষণ বা Absorbance যথাক্রমে 0.21, 0.51, 0.63 এবং 0.9 Absorbance এর বিপরীতে ঘনমাত্রায় লেখচিত্রটি নিম্নরূপ হয়-
অতঃপর অজানা ঘনমাত্রার দ্রবণের মধ্য দিয়ে আলো প্রবাহিত করে এর Absorbance নির্ণয় করা হয়। মনে করি, এর মান হল 0.5। যে বিন্দুতে এ পাঠ মিল হবে তা হবে দ্রবণের ঘনমাত্রা। অর্থাৎ দ্রবণের ঘনমাত্রা হবে 3 ppm।
1cm দীর্ঘ কোষে CCl4 মাধ্যমে A যৌগের অজানা ঘনমাত্রার একটি দ্রবণের Absorbance, 0.68 হলে A যৌগের ঘনমাত্রা কত? (1.1×104 mol−1Lcm−1)
দেওয়া আছে,
A=0.68ϵ=1.1×104 mol−1LCm−1I=1 cmC=?
বিয়ার ল্যাম্বার্ট সূত্র মতে,
A=∈lC
বা, C=ϵlA
বা, c=1.1×104×10.68=6.18×10−5molL−1
1 cm কোষে 1200 litre. mol−1 cm−1 মোলার অ্যাবজর্পটিভিটি (∈) বিশিষ্ট কোন দ্রবণের বিশোষণ (A) কত হবে? যেখানে দ্রবণের ঘনমাত্রা 0.00035M।
বিয়ার-ল্যামবার্ট সূত্র থেকে, A = ∈cl
প্রশ্নে প্রদত্ত মান বসিয়ে, A = 1200 x 0.00035 x 1 = 0.42
উত্তরঃ 0.42
কোন একটি তরঙ্গ দৈর্ঘ্যে 5 cm কোষে একটি দ্রবণের বিশোষণ (A) এবং মোলার অ্যাবজর্পটিভিটি (∈) যথাক্রমে 1.875 এবং 100 litre. mol−1 cm−1 দ্রবণটির ঘনমাত্রা (c) কত?
বিয়ার-ল্যামবার্ট সূত্র থেকে, A = ∈cl
বা, C=ϵlA
প্রশ্নে প্রদত্ত মান বসিয়ে, c=100×51.875M
=0.00375 M
=3.75×10−1 M
উত্তরঃ 3.75×10−1 M
স্পেকট্রোমিটারের 1.0 cm সেলে রাখা 4.48 ppm ঘনমাত্রার KMnO4 এর দ্রবণ 520 nm তরঙ্গদৈর্ঘ্যের আলোর 0.309 ট্রান্সমিটেন্স দেয়। KMnO4 দ্রবণের মোলার বিশোষণ মাত্রা কত?
[KMnO4=158gmol−1]
সমাধানঃ আমরা জানি,
X=(CM)×103
বা, C = =M×103x
=158×1034.48=2.835×10−5molL−1
পারমাণবিক শোষণ বর্ণালিবিশ্লেষণ (Atomic Absorption, UV visible Spectroscopy)
নমুনার ধাতব আয়ন শনাক্তকরণে একটি বহুল ব্যবহৃত পদ্ধতি হল পারমাণবিক বর্ণালি বিশ্লেষণ । বিভিন্ন ধরনের নমুনার ধাতব আয়ন শনাক্তকরণে এ পদ্ধতিটি ব্যবহৃত হয় । যেমন- পানি, রক্ত, মাটি এবং খাদ্য নমুনার ক্ষেত্রে । উদাহরণস্বরূপ রক্তরসে অ্যালুমিনিয়াম উদ্ভিদ, মাটির এবং পানির নমুনায় ক্যালসিয়াম, কপার-সংকরে কপার, সমুদ্রের পানিতে ক্রোমিয়াম, উদ্ভিদে লৌহ এই পদ্ধতি ppm রেঞ্জে শনাক্তকরণে খুবই কার্যকর । তবে পদ্ধতির উন্নয়ন সাপেক্ষে আরও সূক্ষ্ম লেভেলেও কার্যকর ।
পারমাণবিক শোষণের মূলনীতিঃ বোর পরমাণু মডেলের অন্যতম দু’টি স্বীকার্য হলো-
পরমাণুর ইলেকট্রনসমূহ নির্দিষ্ট শক্তির কতগুলো বৃত্তাকার স্থায়ী নিউক্লিয়াসের চতুর্দিকে আবর্তন করে । এ সকল কক্ষপথে আবর্তন কালে ইলেকট্রন কোন শক্তি শোষণ বা বিকিরণ করে না ।
তবে বহিরাগত উৎস থেকে শক্তি প্রয়োগ করা হলে নির্দিষ্ট কক্ষপথে পরিক্রমণরত ইলেকট্রনগুলো একটি নির্দিষ্ট পরিমাণ শক্তি শোষণ করে উত্তেজিত হয়ে শক্তিস্তরে স্থানান্তরিত হয় । বহিরাগত শক্তির উৎস সরিয়ে নিলে উচ্চস্তরের উত্তেজিত ইলেকট্রনগুলো একটি নির্দিষ্ট পরিমাণ শক্তি বিকিরণ করে নিম্নতর শক্তি স্তরে (অধিকতর স্থায়ী) ফিরে আসে । এভাবে ইলেকট্রনের এক শক্তিস্তর থেকে অন্য শক্তিস্তরে স্থানান্তরকালে একটি নির্দিষ্ট পরিমাণ শক্তির শোষণ অথবা বিকিরণই হলো পারমাণবিক বর্ণালির মূলনীতি ।
প্রত্যেক ধাতু বৈশিষ্ট্যমূলক তরঙ্গদৈর্ঘ্যের বা কম্পাঙ্কের আলো শোষণ করে ।

অউত্তেজিত বাষ্পায়িত ধাতব পরমাণু বহিঃস্থ উৎস হতে বৈশিষ্ট্যমূলক কম্পাঙ্কের আলোক রশ্মি শোষণ করে উত্তেজিত হয় যা নিম্নশক্তির অবস্থা হতে উত্তেজিত অবস্থায় স্থানান্তর করে ।
UV-visible spectroscopy
সূচনাঃ তাড়িৎ চৌম্বকীয় রশ্মির 200nm হতে 400nm তরঙ্গ দৈর্ঘ্যের রশ্মিকে অতিবেগুনী (Ultraviolet) এবং 400nm হতে 750nm তরঙ্গ দৈর্ঘ্যের রশ্মিকে দৃশ্যমান অঞ্চল বলা হয় । কম আকর্ষণে আবদ্ধ ইলেকট্রনসমূহ যেমন নন-বন্ডিং ইলেকট্রন বা পাই-বন্ডিং ইলেকট্রন উত্তেজিত বা উচ্চ শক্তিস্তরে উন্নীত করার জন্য অতিবেগুনী-দৃশ্যমান অঞ্চলের তরঙ্গদৈর্ঘ্যের রশ্মির বিকিরণ যথেষ্ট । এই অঞ্চলে আলোকরশ্মি শোষণ করার জন্য অণুসমূহকে অবশ্যই কনজুগেটেড দ্বি-বন্ধন থাকতে হবে । অণুতে খুব বেশি পরিমাণে কনজুগেশন থাকলে অণুটি দৃশ্যমান অঞ্চলে রশ্মি শোষণ করবে ।
মূলনীতিঃ আণবিক অরবিটাল তত্ত্ব (molecular orbital theory) অনুযায়ী যখন কোন যৌগকে UV-visible বা অতিবেগুনী দৃশ্যমান রশ্মি দ্বারা উত্তেজিত করা হয় তখন ইলেকট্রন বন্ডিং অরবিটাল (bonding orbital) হতে অ্যান্টিবন্ডিং অরবিটালে (anti-bonding orbital) স্থানান্তরিত হয় । ইলেকট্রনের এ স্থানান্তরে ইলেকট্রনীয় বর্ণালীর সৃষ্টি হয় । 𝜋 বন্ধন যুক্ত যৌগ সমূহে রশ্মি শোষিত হলে ইলেকট্রন সর্বোচ্চ অধিকৃত আণবিক অরবিটাল (Highest occupied molecular orbit, HOMO) হতে উচ্চতর শক্তির নিম্নতর অনধিকৃত অরবিটালে (Lowest unoccupied molecular orbital, LUMO) তে প্রবেশ করে । এক্ষেত্রে সাধারণত 4টি ইলেকট্রনীয় স্থানান্তর দেখা যায় ।
UV-visible রশ্মির কোন তরঙ্গ দৈর্ঘ্যের অণু কর্তৃক শোষিত হবে তা নির্ভর করে অণুর ইলেকট্রনীয় কাঠামোর উপর যে সব অণুর ইলেকট্রনের স্থানান্তরের জন্য অধিক শক্তির প্রয়োজন তারা কম তরঙ্গ দৈর্ঘ্যের রশ্মি শোষণ করে । কনজুগেটেড বা একান্তর দ্বি-বন্ধন যুক্তযৌগে 𝜋 → 𝜋* ইলেকট্রন স্থানান্তরের সময় একান্তরের জন্য রশ্মির শোষণ মাত্রা কম হয় । ফলে কোন জৈব যৌগে যত বেশি কনজুগেশন থাকে সেই যৌগের অধিশোষণে তত বেশি হয় এবং সেই যৌগ তত বেশি দৃশ্যমান বর্ণালির দিকে স্থানান্তরিত হয় ।
প্রয়োগঃ
১. UV-visible বৰ্ণালী প্রধানত কোন নমুনায় যৌগের ঘনমাত্রা নির্ণয়ে ব্যবহৃত হয় ।
২. যৌগে কার্যকরী গ্রুপের উপস্থিতি নির্ণয়ে ব্যবহৃত হয় ।
৩. জৈব ও অজৈব যৌগের পরিমাণগত বিশ্লেষণে ব্যবহৃত হয় ।
৪. জৈব যৌগের শনাক্তকরণ ও কাঠামোগত বিশ্লেষণে ব্যবহৃত হয় ।
HPLC(High Performance Liquid Chromatography):
উচ্চ দক্ষতা তরল ক্রোমোটোগ্রাফীকে সংক্ষেপে HPLC বলে । যার পূর্ণনাম High Performance Liquid Chromatography । তরল ক্রোমাটোগ্রাফির সাথে গ্যাস ক্রোমাটোগ্রাফীর তত্ত্ব ও যান্ত্রিক ব্যবস্থা সমন্বয় ঘটিয়ে যে উচ্চতর দক্ষতা সম্পন্ন ক্রোমাটোগ্রাফী পাওয়া যায় তাকে উচ্চ দক্ষতা তরল ক্রোমাটোগ্রাফী বলে । এর সাহায্যে বিভিন্ন ঔষধ, যৌগ বা আয়ন শনাক্ত করা যায় ।
গ্যাস ক্রোমেটোগ্রাফি ও উচ্চ দক্ষতার তরল ক্রোমেটোগ্রাফ এর পার্থক্য তুলনা কর ।

GC (গ্যাস ক্রোমোটোগ্রাফী)
যে বিশ্লেষণী পদ্ধতিতে স্থির তরল স্তর বা নিষ্ক্রিয় কঠিন অবলম্বকের সংস্পর্শে বাহক গ্যাস (He বা N2) প্রবাহিত করে মিশ্রণ থেকে উপাদানসমূহকে পৃথকভাবে আঙ্গিক ও মাত্রিক বিশ্লেষণের মাধ্যমে পৃথকীকরণ করা হয় তাকে গ্যাস ক্রোমোটোগ্রাফী বলে ।
গ্যাস ক্রোমোটোগ্রাফী মিশ্রণের উপাদান পৃথকীকরণ, শনাক্তকরণ ও পরিমাণ নির্ণয়ে ব্যাপকভাবে ব্যবহৃত হয় এবং গুরুত্বপূর্ণ পৃথকীকরণ কৌশল । প্রকৃতপক্ষে গ্যাস ক্রোমোটোগ্রাফী কলাম ক্রোমোটোগ্রাফীর অন্তর্ভুক্ত । এখানে সচল মাধ্যম হিসেবে হিলিয়াম, নাইট্রোজেন বা হাইড্রোজেন গ্যাস ব্যবহৃত হয় যাদের বাহক গ্যাস বলে । গ্যাস ক্রোমোটোগ্রাফী পরিশোষণ ও বিভাজন দুই শ্রেণির । পরিশোষণের ক্ষেত্রে স্থির মাধ্যম কঠিন ও সচল মাধ্যম গ্যাস বলা হয় । এ জাতীয় ক্রোমোটোগ্রাফীকে গ্যাস কঠিন ক্রোমোটোগ্রাফী বা GSC বলে । বিভাজন শ্রেণির ক্ষেত্রে স্থির মাধ্যম তরল ও সচল মাধ্যমে গ্যাস হয় । এ জাতীয় ক্রোমোটোগ্রাফীকে গ্যাস তরল ক্রোমোটোগ্রাফী বা GLC বলে । GSC ও GLC কে একত্রে GC দ্বারা বুঝানো হয় ।
বৈশিষ্ট্যঃ
১. GC তে ব্যবহৃত যন্ত্রপাতি অন্যান্য ক্রোমোটোগ্রাফীর তুলনায় ব্যয় বহুল ।
২. GC সহজে ও দ্রুততার সাথে মিশ্রণ পৃথকীকরণ করতে সক্ষম ।
৩. GC তে কলামের তাপমাত্রা ব্যাপক পরিসরে পরিবর্তন হয় ।
৪. GC বিশেষত জৈব যৌগের ক্ষেত্রে ব্যবহৃত হয় ।
৫. GC এর সাম্য খুব দ্রুত স্থাপিত হয় ।
GC এর প্রয়োগঃ
১. মাতাল ড্রাইভারদের রক্তে অ্যালকোহলের পরিমাণ নির্ণয়ে GC ব্যবহৃত হয় ।
২. হাইড্রোকার্বন ও পেট্রোলিয়াম বিশ্লেষণে GC ব্যবহৃত হয় ।
৩. অ্যালকোহল ও ফেনল পৃথক করতে GC ব্যবহৃত হয় ।
Read more